『小児がんの現状と課題:A brilliant future for all the children and adolescents with cancer』
小児がんセンター 血液腫瘍科
診療部長富澤 大輔
I. はじめに
毎年2月15日は「国際小児がんの日(International Childhood Cancer Day)」として、世界中で様々な小児がん啓発イベントが開催されます1)。 この活動は、2002年に5大陸にまたがる世界90か国における167の小児がん患者の親の会の国際ネットワークであるChildhood Cancer Internationalによって提唱されました。 現在、毎年40万人以上の子どもたちが世界中でがんと診断されています。 小児がんの生存率は先進国では80%に達しますが、発展途上国では20%にすぎません。 世界保健機構(WHO)は、がんと闘う子どもたちのすべての痛みと苦しみを取り除き、2030年までに世界中でがんと診断されたすべての子どもたちの生存率を、少なくとも60%に達成することを目標としています。 本コラムでは、そのような小児がんのわが国における現状と課題について概説いたします。
II. 小児がんと成人がんとの違い
小児がんとは、小児期(0〜15歳未満)に発生する悪性腫瘍の総称です2),3)。 ここでは、まず総論として小児がんと成人がんとの違いについて記しつつ、小児がんの現状と課題について考えてみたいと思います。
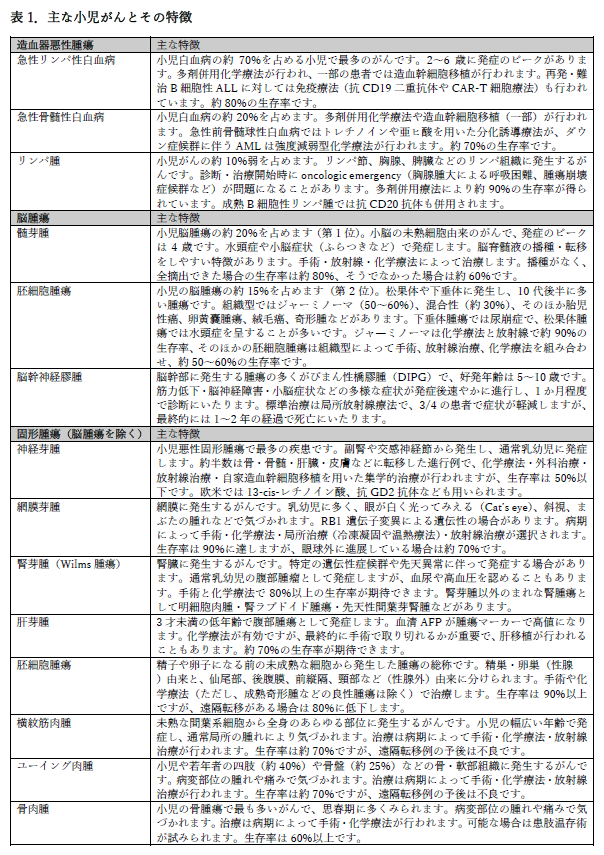
1. がんの種類の違い小児がんは、国際小児がん分類では主分類で12種類、小分類で47種類に分類されています4)。 成人のがんの多くは、いわゆる5大がん(胃がん、肺がん、乳がん、大腸がん、肝がん)に代表されるような上皮細胞から発生するがんが大部分を占めるのに対し、 小児がんは約半数が造血器から発生するがん(白血病やリンパ腫など)であり、 約15%が脳腫瘍、その他の多くは未分化な細胞を起源とする胎児性腫瘍(神経芽腫、網膜芽腫、腎芽腫、肝芽腫、胚細胞腫瘍など)や肉腫とよばれる非上皮性細胞から発生するがん(横紋筋肉腫、ユーイング肉腫、骨肉腫など)です(図1)。
2. がんの発生頻度の違い
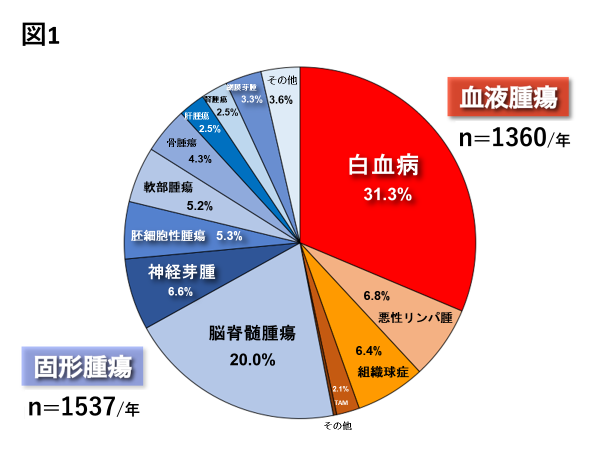
現在本邦では1年間に約100万人の患者ががんに罹患し、約38万人のがん患者が死亡しています5)。 一方、小児がんは毎年約2500人の新規患者が発生しており、小児人口1万人あたり1人の割合です。 このように小児がんは成人がんと比較するとまれではありますが、治療の進歩により生存率が全体で約80%に達した現在でも(図2)、1歳以上の小児期の病死原因としては依然第1位のままです6)。 エルビス・プレスリー生誕の地として有名な米国メンフィス市にSt. Jude Children’s Research Hospitalという世界有数の小児がん専門病院があるのですが、 同病院の創始者であるDanny Thomas氏(米国のエンターテイナー)の理念は“No child should die in the dawn of life(すべての子どもたちが人生の夜明けに命を失ってしまうようなことがあってはならない)”というものでした。 その意味においても、まだまだ満足できる状況にないことは明白です。
3. がんの発症要因の違い
がんは、元々正常な細胞であったものに遺伝子変異が蓄積することで細胞自体の性質が変化し、正常な機能を失い、無秩序に増殖することで発生します。 遺伝子変異を起こす理由として、成人の場合は老化を背景に、喫煙(肺がんなど)や感染(肝細胞がんにおけるB型肝炎やC型肝炎ウイルス、 胃がんにおけるヘリコバクター・ピロリ菌、子宮頸がんにおけるヒトパピローマウイルス[HPV]など)、食生活(欧米型の食生活と大腸がんなど)などの環境要因の関与が大きいことが知られています。 一方、小児がんの場合は大部分が原因不明であり、少なくとも環境要因や生活習慣とは直接は無関係です。 ただ、小児がんの約10%に、何らかの遺伝的背景があることが最近明らかになりました。 古くから、ダウン症候群(白血病の発症率が高い)などの染色体異常症候群や、Beckwith-Wiedemann症候群(肝芽腫や腎芽腫の発症率が高い)、 遺伝性網膜芽腫(RB1遺伝子の変異)などの家族性腫瘍症候群と小児がん発症との関連が知られていましたが、 近年の遺伝子解析技術の進歩によって、明らかな基礎疾患を持たない子どもの一部に、がんの発症リスクとなる生殖細胞系列の遺伝子変異(TP53遺伝子変異など)があることがわかってきました7)。 現在、がん診療にゲノム医療の実装が進みつつありますが、網羅的遺伝子解析によってこのような“隠れ”家族性腫瘍症候群の患者が多く発見されることが予想され、 適切な遺伝カウンセリング体制の整備やフォローアップ体制の構築がこれまで以上に必要になってくると思われます。
4.がんの進行の速さの違い
小児がんのがん細胞は一般的に増殖スピードが早く、実際に診断されたときにはすでに進行した状態であることが非常に多いのです。 ただ、これは悪いことばかりではなく、その性質故に抗がん剤や放射線治療などの効果が高く(一般に抗がん剤や放射線治療は増殖の早い細胞により高い効果を発揮します)、 生存率が成人がんと比較して高い理由のひとつでもあります。 また、比較的ゆっくりと進行する成人がんと異なり、小児がんでは早期発見・早期診断が生存率の向上に結びつくとは限りません。 これは、がん治療の主役が成人がんでは外科手術である(したがって転移する前に取り切らなければならない)のに対して、小児がんでは化学療法であることの違いや、 小児がんの生存率はがん細胞自体の性質や化学療法への治療反応性によってより強く規定されることによります。 ただし、oncologic emergency(腫瘍学的緊急事態)とよばれるがんによって引き起こされる生命にかかわる、 あるいは不可逆的な後遺障害につながり得る合併症に対しては、早期の対応が必要であることは言うまでもありません。
5. がん治療への患者の耐用性の違い
成人のがん患者では、がん以外にも高血圧や糖尿病などの基礎疾患があったり、 心臓や肺、肝臓などの臓器の機能が小児と比較して生理的に低いことがしばしばあり、このことが治療を行う上で問題になることがあります。 例えば、急性リンパ性白血病(ALL)の治療では、6-メルカプトプリンなどの内服の抗がん剤を用いた化学療法(維持療法)を1年以上にわたって行いますが、 小児患者ではほとんどの場合大きな副作用を起こすことなく遂行可能であるのに対し、成人患者では副作用のために治療を完遂できないことがしばしばあります8)。 小児がんの治療成績が一般的に成人がんと比較して良好である理由は、小児がん自体が化学療法の感受性が高いことに加えて、小児患者の方が強力な治療に耐えられ、 治療を中断なく遂行可能であることも一因といえます。
6. 医薬品開発をめぐる環境の違い
一口に小児といっても、乳児、幼児、学童、思春期と体格はもちろんのこと、代謝の違いを含めて薬物動態も年齢群によって異なるため、 成人で規定された医薬品の用法・用量をそのまま体重や体表面積に応じて当てはめることが不適切であることは自明です。 また、当然ながら内服薬については、乳幼児が錠剤やカプセル剤をそのまま飲むことはできませんので、散剤や液剤の開発が必要になります。 フランスの啓蒙思想家Jean-Jacques Rousseauは、その著作『エミール、または教育について(Émile, ou De l’éducation)』の中で「子どもは小さな大人ではない」と記していますが、まさに言い得て妙です。 しかし現実は、製薬企業による医薬品開発は成人中心であり、本邦で2010〜2018年度に用法・用量が承認された225件中、小児の用法・用量の承認件数はわずか18件に留まっています9)。 実際に小児がんの化学療法や造血幹細胞移植の多くは、小児の用法・用量が記載されていない状況、すなわち適応外で実施されているのが現状です。 このことは大きく2つの問題があり、ひとつはその医薬品の使用法が最適化されていないことで、十分な効果が得られない可能性、安全性に問題が生じる可能性があります。 ふたつ目は費用の問題であり、適応外であるが故に医療機関において保険診療上査定を受ける可能性が出てきます。 本邦では医薬品が承認されるためには原則企業治験または医師主導治験の実施が必要になりますが、 小児がんはその希少性(必要な被験者数を集めるのに時間と治験実施施設の数を要する)、倫理的ハードルの高さ(本人から直接同意を得ることができない)、 年齢によるバリエーションの大きさ(剤型開発、薬物代謝・薬物動態の違いによる年齢群別の用法・用量の設定)など開発労力が大きいことが、開発を進めることを躊躇させる要因となっています。 本邦も参加している医薬品規制調和国際会議(ICH)では2000年に「小児集団における医薬品開発の臨床試験に関するガイダンス」(ICH E11)を発出し、小児の医薬品開発を促進することの重要性を謳っていますが、 米国では1997年以降関連法が整備されて現在はFDASIA(Food and Drug Administration [FDA] Safety and Innovation Act)が、 欧州では2007年にPaediatric Regulationが法制化され、製薬企業に小児向け医薬品開発計画を義務化する一方で、見返りに優先審査や特許期間延長等のインセンティヴを付与する等の施策を実施しています。 対する本邦の状況は、2000年に「小児集団における医薬品の臨床試験に関するガイダンス」(医薬審第1334号)が、 2015年に「小児悪性腫瘍における抗悪性腫瘍薬の臨床評価方法に関するガイダンス」(薬食審査発0930第1号 )が厚生労働省医薬安全局審査管理課長通知として発出されたのみで、強制力はありません。 もちろん欧米においてでさえも、依然として成人向け医薬品開発と小児向け医薬品開発とに格差がありますが、2010〜2018年度の間に米国では27品目の血液・腫瘍領域の医薬品が小児向けに承認され、 このうち本邦で承認が得られたのは5品目のみです。 なお、先に述べた本邦で承認された18品目というのは、ほとんどが既存薬の適応拡大ですので、新規医薬品の承認は非常にわずかなのです。 近年状況は少しずつ改善しつつありますが、どのように小児に対する医薬品開発を進めていくのか、医療者、規制当局、製薬企業、患者団体の各ステークホルダーが協調して取り組むことが必要です。 一方、小児がんでは歴史的に多施設共同臨床研究グループによる治療開発が盛んに行われており、小児がんの治療成績向上に多大な貢献をしてきました。 小児がんでは参加可能な臨床試験がある場合は、ほぼ100%の患者が参加することも大きな特徴です。 本邦でも複数に分かれていた研究グループが2014年に日本小児がん研究グループ(JCCG)として統合し、全国150余りの小児がん診療施設が参加しています。 2018年には臨床研究法が施行され、JCCGの臨床試験もすべて特定臨床研究として法規制下で実施されています。 将来的には、このような特定臨床研究で得られたデータも用いて、小児がん治療に必要な医薬品の承認や適応拡大が得られるようになることが望ましいと考えます。
7. 小児がん経験者ではがん克服後の生存期間が長い
これは当然といえば当然ですが、成人のがん患者に比べて、小児のがん患者の方が、がん克服後から平均寿命到達までの期間が長くなります。 したがって、小児がんでは成人がん以上に、がん治療に伴って起こる様々な晩期合併症を極力少なくする努力が求められます。 小児がんの生存率が向上すればするほど、小児がん経験者の数は増加するわけで、現在その数は成人600〜1000人に1人と言われています。 彼らが、彼女らが60年、70年と十分なquality of life(QOL)を伴った人生を全うできるようにすることがとても重要です。 米国の著名な小児がん専門医であるGiulio D’Angio先生は1975年の時点ですでに “Cure is not enough(がんの治癒だけでは不十分である)”という言葉を述べられています10)。 実際、小児がんで最多の疾患であるALLでは、晩期合併症のリスクとなりやすい造血幹細胞移植や放射線の頭蓋照射の適応を縮小する方向で治療開発が進められており、 そのほかのがん種でも同様の努力がなされています。 一方で、小児がんの高い生存率を維持・発展させるためには一定の強度の化学療法を含めた抗腫瘍治療が必要ですし、 再発・難治の小児がん患者に対しては命を助けるために非常に強力な治療が必要で、晩期合併症を完全に回避することが難しいのも事実です。 したがって、治療後の長期フォローアップはとても重要であり、全国の小児がん治療施設がそれぞれ工夫しながら頑張っています。 しかしながら、すでに一定の障害を抱えている場合は障害者手帳等の既存助成制度を利用することができるものの、 そこまでは至らない程度の障害を抱えなおかつ医療が必要な小児がん経験者にとっては、 小児慢性特定疾病医療費助成制度の対象外となる20歳になった途端に多大な医療費負担を背負うことになるなど、制度面での課題が数多くあります。 また、20歳を超えて小児診療から成人診療への移行が必要となっても、小児がん経験者の診療を受け入れることのできる成人診療科がなかなか見つからないことも多いのが現状です。
8.AYA世代のがん
小児と成人の端境期の世代、すなわち思春期・若年成人を“AYA (Adolescents & Young Adults)”といい、15〜39歳の患者があてはまります。 本邦では年間に約2万人のAYA世代の患者ががんに罹患しています。 15〜19歳の思春期の患者では、白血病、リンパ腫、骨軟部腫瘍、脳腫瘍などの小児がんで多い疾患が多いのに対し、 20歳以降、特に30歳代では、乳がんや子宮頸がん、消化器がんなどの成人型のがんが増えてきます11)。 小児型のがんについては、小児血液・腫瘍専門医が直接またはその協力の元に成人がんの専門医が担うのが望ましいといえます。 特に、急性リンパ性白血病(ALL)については、小児型の治療プロトコールで治療した方が良好な成績が得られることが国内外のデータから明確に示されています12)。 一方、成人型のがんについては、やはり成人がんの専門医が担うべきです。 この世代で子宮頸がんが非常に多いことからも、現在積極的勧奨の差し控えとなっているHPVワクチン接種について、何とかする必要があると考えます13)。
AYA世代の患者は、思春期であればそれまでの学校生活や友人との付き合いが中断されるなど、大きな影響を受けます。 現在、多くの小児がん診療施設では、院内学級や訪問学級が整備され、義務教育である小学校・中学校教育については対応できているものの、 高等教育については小児がん拠点病院であっても十分に対応できていないのが現状です。 単位認定など制度上の問題の改善のほか、オンライン教育の活用などで積極的な学習支援を行い、退院後の円滑な日常生活への復帰ができるよう、後押しする必要があります。 若年成人の場合も、就労、結婚、出産などの様々なライフイベントを迎える時期と重なることから、がんに罹患することで精神的・身体的・経済的困難を抱えることも少なくありません。 いずれの世代についても、患者のライフステージや状況に応じた支援が必要であり、医師や看護師だけではなく、多職種によるサポートが必要になります。 また、この世代は内服薬や通院のコンプライアンス不良など、治療アドヒアランスの不良がしばしば問題になります。 患者自身へのがん教育も含めて、対策をとることが重要です。
III. 小児がんの種類とその特徴について
次に、代表的な小児がんをいくつかとりあげて、その特徴や治療方法について概説いたします(表1)。
1. 白血病・リンパ腫白血病は造血組織である骨髄で発生する造血器悪性腫瘍であり、小児がんの約30〜40%を占める最多の疾患です。 急性リンパ性白血病(ALL)が約70%、急性骨髄性白血病(AML)が約20%を占めます。 ALLは2〜6歳に発症のピークがあり、その後は年齢とともに発症頻度が低下しますが、AMLは年齢とともには発症頻度が増加し、20歳前後でALLを逆転します。 一方のリンパ腫は、リンパ節や胸腺、脾臓などの末梢リンパ組織に発生する造血器悪性腫瘍で、小児がんの10%弱を占めます。 ホジキンリンパ腫と非ホジキンリンパ腫とに分かれますが、本邦では20歳以下のリンパ腫の約90%が非ホジキンリンパ腫です。
白血病では、造血障害(正常白血球の減少による易感染性、貧血による易疲労感や顔色不良、血小板減少による出血傾向)や骨髄外臓器への白血病細胞の浸潤による症状(リンパ節腫大、肝脾腫、睾丸腫大、骨関節痛、中枢神経系浸潤による頭痛・顔面神経麻痺など)を引き起こします。 一方、リンパ腫ではリンパ節腫大(腸管リンパ節が腫大して腸閉塞を起こすことも)、胸腺腫大による呼吸困難、中枢神経系浸潤による頭痛・四肢麻痺などで発症します。 腫瘍細胞から放出されるサイトカインによって発熱などの症状を呈する場合もあります。 がん全般にいえますが、必ずしもがん特有の症状があるわけではないため、何某かの症状の①程度が重い、②なかなかよくならない(1〜2週間以上つづく)、 ③時間経過とともに悪化する場合は、医師の診察を受けてください。 診察の結果、臓器腫大や血液検査の異常などが認められれば、そこから先は小児血液・腫瘍専門医に委ねられることになります。
白血病の診断は骨髄検査によって、リンパ腫の診断は腫大病変の生検によって行われます。いずれも病理学的な形態診断のみでは不十分であり、 採取した骨髄検体や生検組織検体を用いた細胞表面・細胞質内抗原検査、遺伝子・染色体検査が病型診断や予後予測、治療決定に必要です。 リンパ腫の場合は病変の広がりを調べるためにCTやMRIなどの画像検査も行われます。最近はPET-CT検査を行うこともあります。
治療の主体は多剤併用化学療法です。 まずは、骨髄検査や画像検査で腫瘍の残存が確認できない状態(「寛解」といいます)を目指した寛解導入療法が行われ、 引き続いて検査で確認できないレベルの残存腫瘍(微小残存腫瘍[MRD])を消滅させるための強化療法が繰り返し行われます。 中枢神経系の腫瘍細胞を標的として抗がん剤の髄腔内投与(髄注)も行われます。 再発リスクが高いと考えられる場合は、放射線治療や造血幹細胞移植が行われることがあります。 また、近年白血病・リンパ腫の分野では免疫療法の開発が著しく、成熟B細胞性リンパ腫では抗CD20抗体リツキシマブを併用した化学療法が、 再発・難治ALLでは抗CD19二重特異抗体ブリナツモマブ、キメラ抗原受容体(CAR)T細胞療法なども行われています。 現在、ALL、AML、リンパ腫の生存率は、それぞれ約80%、70%、90%です。
2. 脳腫瘍
脳腫瘍は2番目に多い小児がんです。 成人の脳腫瘍の多くが大脳皮質に発生するのに対し、小児ではテント下と呼ばれる小脳(髄芽腫、上衣腫、星細胞腫、非定型ラブドイド奇形腫様腫瘍)、 下垂体や松果体(胚細胞腫)、視床下部(星細胞腫)、視神経(視神経膠腫)、脳幹(神経膠腫)などに好発します。 症状は腫瘍の発生部位により、頭痛や嘔気・嘔吐、発達遅滞、けいれん、水頭症による症状(過敏性、無気力、大泉門膨隆、頭囲拡大、乳頭浮腫、Parinaud徴候など)など多彩です。 特に頭蓋骨が癒合する前の乳児期では症状が現れにくいので注意が必要です。 下垂体腫瘍では、尿崩症(多飲、多尿)で発症することも多いです。
診断の第一歩はMRIなどの画像診断です。 多くの場合、病型診断のために組織診断が必要であり、腫瘍切除の一環として行われますが、 小児の脳腫瘍では多くの場合、腫瘍発生部位近辺に内分泌や生命中枢があることから治癒的切除が困難なことが少なくありません。 また、脳幹神経膠腫や胚細胞腫瘍の場合ははじめから治癒的切除は行われません。 水頭症を軽減するためにシャントやオンマヤ槽留置が行われることもあります。 治療は外科手術に加えて、化学療法、放射線治療を組み合わせた集学的治療が基本ですが、化学療法・放射線治療が無効な成熟奇形腫ではこれらの治療は行われませんし、 上衣腫も化学療法が無効であることから原則行われません。 現在、小児脳腫瘍の生存率は概ね70%程度ですが、有効な治療法に乏しい脳幹神経膠腫では1〜2年の経過で死亡に至ります。 脳腫瘍の治療では、脳自体への手術や放射線治療の侵襲が大きくならざるを得ないため、内分泌合併症や神経・認知合併症のリスクがどうしても大きくなります。 したがって、経験者に対する適切な長期フォローアップを行うことが非常に重要です。
3. 悪性固形腫瘍(脳腫瘍を除く)
脳腫瘍を除く小児の悪性固形腫瘍は、神経芽腫、網膜芽腫、腎芽腫、肝芽腫、胚細胞腫瘍などの胎児性腫瘍と、横紋筋肉腫、ユーイング肉腫、骨肉腫などの肉腫に大きく別れます。 ここでは、その中で最も多い神経芽腫をとりあげます。神経芽腫は副腎や交感神経節から発生する悪性腫瘍で、主として乳幼児期にみられます。 腫瘍がカテコラミンを産生するため、尿中VMA、HVAが腫瘍マーカーとして有用です。 患者の半数は、骨、骨髄、肝臓、皮膚、眼窩などに転移した進行例として診断されます。 症状は腹部腫瘍による腹部膨満で気づかれることが多く、腹部腫瘍による胸部圧迫のための呼吸器症状を認めることもあります。 そのほか特殊な症状として、Horner症候群、オプソクローヌス(特徴的な眼球運動)・ミオクローヌス(不随意運動の一種)、 小脳性運動失調、脊柱管内への腫瘍進展による神経麻痺、腫瘍が産生したカテコラミンによる異常発汗や高血圧、血管作動性腸ペプチド産生による水様下痢などが見られることがあります。 診断は、原発腫瘍または転移巣の生検によって病理組織学的に行いますが、そのほか病期判定のためにCTやMRIなどの画像検査、MIBGシンチグラフィー、骨髄検査などが必要であり、 ほかに診断時年齢、病理組織分類、遺伝子染色体所見(MYCN遺伝子増幅の有無、染色体11q領域欠失の有無、核DNA量)などの情報を総合してリスク分類を行います。 超低リスク群では無治療経過観察、低リスク群では外科切除のみですが、中間リスク以上では外科切除に加えて化学療法が必要となり、 特に高リスク群では大量化学療法および自家末梢血幹細胞移植が必須で、放射線治療も行われます。 欧米では後治療として13-cisレチノイン酸(イソトレチノイン)による分化誘導療法が標準的に行われ、最近では抗GD2抗体を用いた免疫療法も標準的に用いられていますが、現時点ではいずれも本邦では未承認です。 特にイソトレチノインは欧米でもにきびの治療薬としてしか承認されていないため(欧米では承認内容と保健償還の関係が1対1ではないため、必ずしも当該疾患に対する適応を必要としない)、本邦において公知申請等で承認を得るのが難しい状況にあります。 また、古い医薬品であり、欧米ではすでにジェネリック品も多数発売されているため、国内で新たに治験を実施することも簡単ではなく、 本邦では神経芽腫患者の多くが個人輸入でイソトレチノインを使用している実態があります。 進行神経芽腫の生存率は50%に満たず、予後の改善が急務といえます。 しかしながら、白血病やリンパ腫の場合は同じ疾患が成人にも存在することから、必要な新規医薬品について少なくとも成人向き開発が行われることが期待できますが、 悪性固形腫瘍の場合は小児特有の疾患が多いため、開発すらされないリスクがあり、大きな課題です。
IV. 小児がん拠点病院の取り組み
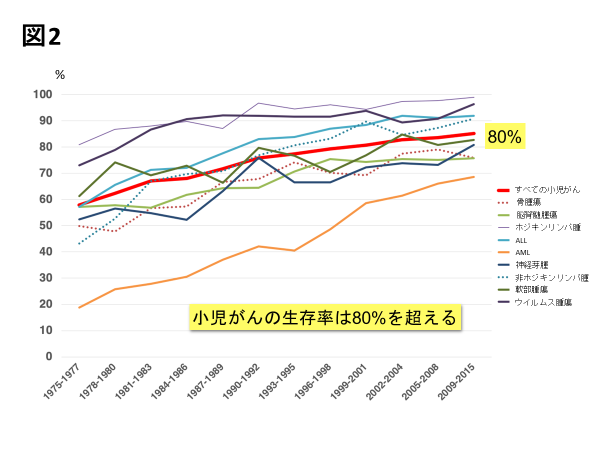
わが国のがん対策を総合的かつ計画的に推進することを目的として2006年6月に成立した「がん対策基本法」に基づき、 2012年6月に閣議決定された「第2期がん対策推進基本計画」において、小児へのがん対策の充実が重点的に取り組むべき課題としてとりあげられました。 これに基づき、厚生労働省は2013 年2月に全国15 の小児がん拠点病院を指定しました14)。 さらに、2014 年2月には、国立成育医療研究センターと国立がん研究センターが拠点病院を取りまとめる小児がん中央機関に指定し、 相談支援の向上、情報収集・提供、臨床試験の支援、診断・治療などの診療支援、小児がん診療に携わる者の育成、登録体制の整備などの業務が行われています。 2018年3月に策定された「第3期がん対策推進基本計画」では小児のみならずAYA世代のがん医療の充実がうたわれました。 さらに2019年には、地域の質の高い小児がん医療および支援を提供し、一定程度の医療資源の集約化を図るために小児がん連携病院が、全国の小児がん拠点病院によって指定されました。 これら一連の取り組みによって、わが国における小児がん医療の充実が図られています(図3)。
V. おわりに
小児がんの今日的課題は、①難治性小児がんの克服、および②晩期合併症の軽減、にあります。 もちろん、これらの課題解決のためには更なる療養環境の改善も必要です。 100%の合併症なき治癒を目指し、医療者だけでなく社会全体で、子どもたちが命の危険に晒されることのない、笑顔あふれる社会の実現を目指してほしいと強く願います。 筆者のモットーである、“A brilliant future for all the children and adolescents with cancer(すべてのがんを患ったこども達、青年達に明るい未来を)”の言葉を添えて。
<文献>
- 1) International Childhood Cancer Day: ICCD (https://internationalchildhoodcancerday.org)
- 2) 日本小児血液・がん学会編:小児血液・腫瘍学. 診断と治療社, 2015
- 3) 国立がん研究センター小児がん情報サービス(https://ganjoho.jp/child/)
- 4) Steliarova-Foucher E, et al: International Classification of Childhood Cancer, third edition. Cancer 103:1457-1467, 2005
- 5) 国立がん研究センターがん情報サービス:最新がん統計(https://ganjoho.jp/reg_stat/statistics/stat/summary.html)
- 6) 厚生労働省:死亡順位(第5位まで)別にみた年齢階級・性別死亡数・死亡率(人口10万人対)・構成割合(https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/suii09/deth8.html)
- 7) Zhang J, et al: Germline Mutations in Predisposition Genes in Pediatric Cancer. N Engl J Med 373:2336-2346, 2015
- 8) Hayakawa F, et al: Markedly improved outcomes and acceptable toxicity in adolescents and young adults with acute lymphoblastic leukemia following treatment with a pediatric protocol: a phase II study by the Japan Adult Leukemia Study Group. Blood Cancer J 4:e252, 2014
- 9) 特立業性法人医薬品医療機器総合機構:小児医薬品WG、発表実績等、令和2年1月「小児がんの医薬品開発に関する最近の状況」(第3回小児がんのための薬剤開発を考える、東京)(https://www.pmda.go.jp/files/000233567.pdf)
- 10) D’Angio GJ: Pediatric cancer in perspective: cure is not enough. Cancer 35:866-870, 1975
- 11) 国立がん研究センターがん情報サービス:最新がん統計、小児・AYA世代のがん罹患(https://ganjoho.jp/reg_stat/statistics/stat/child_aya.html#a4)
- 12) Boissel N, et al: Acute lymphoblastic leukemia in adolescent and young adults: treat as adults or as children? Blood 132:351-361, 2018
- 13) Lei J, et al: HPV Vaccination and the Risk of Invasive Cervical Cancer. N Engl J Med 383:1340-1348, 2020
- 14) 国立成育医療研究センター:小児がん拠点病院(https://www.ncchd.go.jp/center/activity/cancer_center/cancer_kyoten/)
図1. 日本の小児がんの内訳:小児がん拠点病院情報公開2015〜2017年の集計データより
図2. 年代別小児がんのがん種別の5年生存率:米国Surveillance, Epidemiology, and End Results Program (SEER)のデータより
図3. 全国の小児がん拠点病院(2020年1月現在)
1999年 東京医科歯科大学医学部医学科卒業
1999年 東京医科歯科大学医学部附属病院小児科 研修医
2000年 日本赤十字社医療センター小児科 研修医
2001年 東京医科歯科大学医学部附属病院小児科 医員
2003年 埼玉県立小児医療センター血液腫瘍科 非常勤職
2004年 東京医科歯科大学大学院発生発達病態学分野 助手
2010年 東京医科歯科大学大学院医歯学総合研究科卒業(医学博士)
2010年 東京医科歯科大学医学部附属病院小児科 助教
2014年 国立成育医療研究センター小児がんセンター血液腫瘍科 医長
2018年 国立成育医療研究センター小児がんセンター血液腫瘍科 診療部長
現在に至る