放射線治療のパラダイム転換か
『ホウ素中性子捕捉療法(BNCT)』
京都大学原子炉実験所・附属粒子線腫瘍学研究センター
小野公二
Ⅰ.BNCTとは
1. 中性子とホウ素原子核の反応を利用すると選択的細胞照射が可能です。
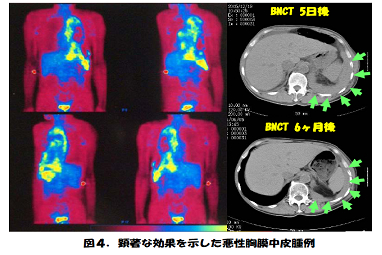
中性子は陽子と共に原子核を構成する粒子で電荷を持っていません。その為、エネルギーの低い熱中性子は原子核に入り込み易い(原子核に捕獲され易いとも言い換え得る)性質を持っています。中性子を取り込んだ原子核では分裂が起こります。ホウ素(B)はホウ素-10(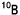 ,天然存在比:19.8 %)とホウ素-11(
,天然存在比:19.8 %)とホウ素-11(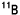 )の混合ですが、何れも安定で自然には核分裂しません(放射能を持たない)。このうち、
)の混合ですが、何れも安定で自然には核分裂しません(放射能を持たない)。このうち、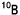 原子核は特に中性子を捕捉し易いのが特徴です。人体の元素では窒素-14(
原子核は特に中性子を捕捉し易いのが特徴です。人体の元素では窒素-14(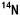 )が中性子を最もよく捕らえます。しかし、
)が中性子を最もよく捕らえます。しかし、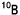 は
は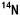 の約2000倍もよく捕らえます。そして、中性子を捕らえた
の約2000倍もよく捕らえます。そして、中性子を捕らえた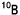 原子核は直ちに、α粒子と7Li原子核の二つに分裂します。
原子核は直ちに、α粒子と7Li原子核の二つに分裂します。これらBNCT粒子は細胞の直径よりも短い距離を走行し停止するので反応が生じた細胞だけが破壊されます。また、極々短い飛跡の周囲に全運動エネルギーを与えるので、殺細胞効果が大変大きいのが特徴で、放医研で臨床使用の炭素イオン線を凌ぎます。
X線では無酸素の場合、有酸素の場合に比べ等しい殺細胞効果を得るのに3倍の放射線が必要です。がん組織には正常組織と異なりがんの特徴でもある低酸素細胞が存在し、X線治療後の再発はこの低酸素細胞が原因と考えられています。しかし、BNCT粒子の効果は酸素の有無に影響されないので、低酸素がん細胞に大変効果的です。
斯うした特長のホウ素中性子捕捉療法(Boron Neutron Capture Therapy・BNCT)の基本アイデアは1936年に米国の物理学者Lockerによって提案されました。 この機序を図で説明すると図1の様になります。
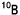 が20ppm((大気中にある物質の比率を表す場合に用いられる表現で、100万分の1の意)。1ppm=0.0001%)以上の濃度で選択的に集積すると、がんは約10倍量の放射線を受けがん細胞選択的照射が実現します。画像上のがん病巣は勿論のこと、検出できない微小ながん病巣も周囲の正常細胞を損傷せずに破壊できます。
が20ppm((大気中にある物質の比率を表す場合に用いられる表現で、100万分の1の意)。1ppm=0.0001%)以上の濃度で選択的に集積すると、がんは約10倍量の放射線を受けがん細胞選択的照射が実現します。画像上のがん病巣は勿論のこと、検出できない微小ながん病巣も周囲の正常細胞を損傷せずに破壊できます。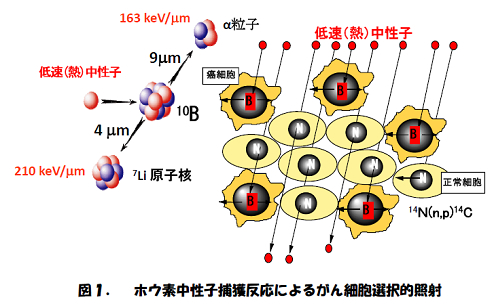
2. BNCTの成功には腫瘍に集積性のあるホウ素化合物が不可欠です。
BNCTでは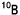 化合物の腫瘍への選択的集積性が不十分だったのが原因でした。
化合物の腫瘍への選択的集積性が不十分だったのが原因でした。その後、ホウ素化合物の開発に努力が払われ、現在、臨床研究では1分子に12個の
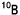 を含むボロカプテイト (BSH)と1分子に1個の
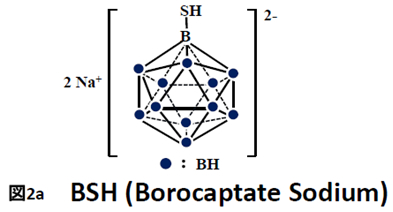
を含むボロカプテイト (BSH)と1分子に1個の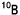 を含むアミノ酸(フェニルアラニン)の誘導体であるボロノフェニルアラニン(BPA)の2種が使われています。構造式を図2に示します。BSH (図2a)は1968年に故畠中教授によって脳腫瘍のBNCTで用いられました。脳には血液脳関門と呼ばれる物質の脳への滲入を監視する関所機能があります。正常脳への滲入はこの機能によって阻止されますが、悪性脳腫瘍ではこの機能が破綻しており、BSHはこの破綻に乗じて脳腫瘍に滲入します。
を含むアミノ酸(フェニルアラニン)の誘導体であるボロノフェニルアラニン(BPA)の2種が使われています。構造式を図2に示します。BSH (図2a)は1968年に故畠中教授によって脳腫瘍のBNCTで用いられました。脳には血液脳関門と呼ばれる物質の脳への滲入を監視する関所機能があります。正常脳への滲入はこの機能によって阻止されますが、悪性脳腫瘍ではこの機能が破綻しており、BSHはこの破綻に乗じて脳腫瘍に滲入します。
一方、BPA(図2b)を臨床開発したのは神戸大学皮膚科の三島教授(現名誉教授)で、当初、悪性黒色腫(黒子のがん)に特異的な化合物と考えていました。 事実、悪性黒色腫では正常皮膚の3〜7倍も集積します。1987年、三島教授により世界初の悪性黒色腫のBNCTで使われました。

その後、黒色腫特異性は否定され、様々ながんに集積することが分かりました。がん細胞は増殖(細胞の分裂)が盛んで、その為にタンパク質の原料となるアミノ酸を正常細胞以上に必要としています。BPAの集積はこうしたがんの特徴によって集積します。
3. BNCTの為には1秒当たりに非常に多くの中性子が照射できる中性子源が必要です。
腫瘍の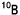 濃度が70-80ppmの場合、1時間程度で治療を完了するのに体表面で必要な中性子数は毎秒5X
濃度が70-80ppmの場合、1時間程度で治療を完了するのに体表面で必要な中性子数は毎秒5X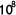 n/cm2 以上です。この中性子数は研究用原子炉でしか得られませんでした。また、
n/cm2 以上です。この中性子数は研究用原子炉でしか得られませんでした。また、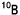 に捕らえられ易い熱中性子は生体内で15-16mm毎に数が半減します。その為、深い部位の腫瘍では十分量の中性子を深部まで到達させることが難しいので、かつて、膠芽腫のBNCTでは開頭手術中に中性子を照射(術中照射)していました。現在はエネルギーのやや高い熱外中性子を用いており脳腫瘍でも術中照射は不要になっています。熱外中性子は生体中でエネルギーを失い熱中性子に変わる為、表面での熱中性子数はピーク(2-3cm深部)の約1/3であり、皮膚線量を大幅に低減できます。これも術中照射が不要になった理由です。
に捕らえられ易い熱中性子は生体内で15-16mm毎に数が半減します。その為、深い部位の腫瘍では十分量の中性子を深部まで到達させることが難しいので、かつて、膠芽腫のBNCTでは開頭手術中に中性子を照射(術中照射)していました。現在はエネルギーのやや高い熱外中性子を用いており脳腫瘍でも術中照射は不要になっています。熱外中性子は生体中でエネルギーを失い熱中性子に変わる為、表面での熱中性子数はピーク(2-3cm深部)の約1/3であり、皮膚線量を大幅に低減できます。これも術中照射が不要になった理由です。1990年以降、我が国では京都大学原子炉(KUR・5MW)と原子力研究開発機構4号炉 (JRR4・3.5MW)が利用されていましたが、JRR4は昨年の大地震以降、運転を休止しています。
Ⅱ.BNCTの実際
1.治療の成功にはBPA集積性の事前検索が役立ちます。
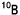 化合物のがん(Tumor):正常組織(Normal tissue)への集積比(T/N)が事前に分かれば効果が期待できる患者さんを選択できます。BPA では
化合物のがん(Tumor):正常組織(Normal tissue)への集積比(T/N)が事前に分かれば効果が期待できる患者さんを選択できます。BPA では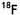 で標識した
で標識した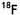 -BPAを用いたPETによって、T/Nをある程度の精度で予測することが可能です。脳腫瘍の
-BPAを用いたPETによって、T/Nをある程度の精度で予測することが可能です。脳腫瘍の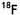 -BPA PET画像をMRI画像と比べると、PETでの高集積の部分とMRIでの造影域とはよく一致します。
-BPA PET画像をMRI画像と比べると、PETでの高集積の部分とMRIでの造影域とはよく一致します。
2. BNCT実施の標準的な手順
膠芽腫の初回治療としてBNCT行う臨床研究プロトコールを例にBNCTの手順を簡単に述べると下記の様になります。BSHとBPAを、各々1および3時間で点滴投与します。BSHの投与は中性子照射の12時間前です。BPA投与の3時間目に中性子を照射します。照射時間は開始直前の血中
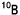 濃度に基づいて決定します。
濃度に基づいて決定します。
Ⅲ. 実施例が示すがんへの選択的効果
1. 悪性神経膠腫
大阪医大脳神経外科との共同研究では診断時からの生存期間中央値が17.3-23.0ヵ月に達しています(図3)。
直近のデータでは2年生存率は50%を超えています。 標準治療であるTMZ併用X線治療の成績と比較してもBNCTの方が良好です。ただ、症例が少ないので確定的な結論を得る為に、現在、多施設共同臨床研究が実施されています。 BNCTでは極めて大きい一回線量を腫瘍に照射できる為、 照射後早期に腫瘍影の縮退、浮腫域の縮小が認められることがあります。 生存率が上昇し、生存期間も延長したことから原発巣の制御は顕著に改善したと判断していますが、その一方で、脊髄等へ播種が顕在化してきました。2年以降の生存率の低下はこれに因るところが大きく、播種対策も今後の研究課題の一つです。
2.再発頭頸部がん
標準治療後の再発頭頸部がんは有効な再治療に乏しいのが現状です。こうした症例にBNCTを試行したところ奏効率は>90%で、24%の長期生存率が得られました。通常は制御不能の巨大な再発腫瘍が完全消失した症例(阪大・歯・口腔外科との共同研究)があります。腫瘍が左顔面の皮膚を破壊し病巣からは血性滲出液が絶えない再発耳下腺がんが、2回分割のBNCTと縮退が不良の耳介下後部の腫瘤への1年後の追加BNCTで完全に退縮しました。一方、皮膚反応は軽度発赤までで、それ以上は進みませんでした。また、別の症例ではBNCT後の手術によって、病理学的にも効果のがん選択性が確認できました(川崎医大・耳鼻咽喉科/放射線治療科との共同研究)。
Ⅳ. 今後の展望
1. 一つの臓器に複数のがん病巣がある場合にも治療の可能性が在ります。
臓器全体に広がるがんの放射線治療は、がん細胞が放射線に弱い場合や臓器が放射線に強い場合にのみ限定されています。臓器が放射線に弱い肺や肝では困難です。しかし、 BNCTのがん細胞選択的照射の特長を活かせば適応できる可能性があります。
我々はラットで肝がんモデルを作り動脈塞栓術でBSHを腫瘍に閉じ込めると、10B濃度が正常肝の数十倍になることを確認し、2005年より多発肝臓がんへのBNCTを試みています。
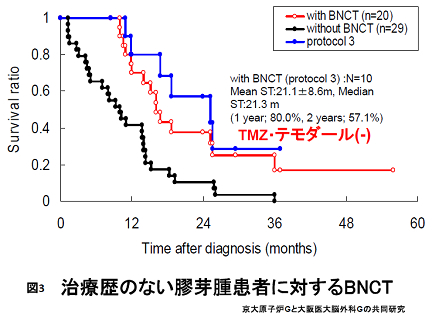
胸膜全体に拡がる悪性胸膜中皮腫は形状が複雑で、がんを治癒させる線量を安全に照射することは高精度X線治療技術をもってしても難しいのが現状です。がんの胸膜播種マウスでBNCT効果を確認した後、2005年12月、アスベストによる悪性胸膜中皮腫の患者に対する世界初のBNCTを試行しました。BNCTの数日後には胸部の激痛が消失する等、QOLの顕著な改善と腫瘍の縮小が確認できました (図4)。
現在、多施設共同の悪性胸膜中皮腫に対する臨床研究がKURを使って進行中です。 BNCTの臨床研究が加速した2001年以降のKURでの症例の内訳を表に示します(表)。多くの世界初の試みを行いました。

2.加速器中性子源の開発に成功しました。
原子炉は優れた中性子源ですが、固有の規制や設置場所の不自由等に因って臨床が非常に制約されます。BNCTが承認がん治療へ発展するには、制約の無い小型加速器中性子源が不可欠です。我々は住友重機械工業株式会社と共同でサイクロトロン中性子源の開発に成功しました(図5)。

かつて速中性子線治療で用いられた実績があり、安全性も確認済みのベリリウム(Be)を標的として中性子を発生させ、それを減速して熱外中性子とするBNCT用加速器中性子照射システムです。目標とした中性子強度と生物学的特性も確認できました。現在、世界初、唯一のBNCT用加速器中性子源です。本システムの性能はKUR附設のBNCT設備の約2倍です。現在、薬事治験の開始に向けて鋭意準備中です。 BNCTはがん細胞選択的照射の特長によってがん放射線治療を別次元に押し上げ、20世紀のがん放射線治療を支配してきたパラダイムを革新する可能性を持っている治療です。

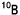 は中性子を
は中性子を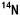 の約2000倍もよく捕らえる、BNCT粒子は細胞の直径よりも短い距離を走行し停止するので反応が生じた細胞だけが破壊される、極々短い飛跡の周囲に全運動エネルギーを与えるので、殺細胞効果が炭素イオン線より大きい、BNCT粒子の効果は酸素の有無に影響されないので、低酸素がん細胞に大変効果的、がんに
の約2000倍もよく捕らえる、BNCT粒子は細胞の直径よりも短い距離を走行し停止するので反応が生じた細胞だけが破壊される、極々短い飛跡の周囲に全運動エネルギーを与えるので、殺細胞効果が炭素イオン線より大きい、BNCT粒子の効果は酸素の有無に影響されないので、低酸素がん細胞に大変効果的、がんに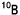 が20ppm(μg/g)以上の濃度で選択的に集積すると、がんは約10倍量の放射線を受けがん細胞選択的照射が実現し、画像上のがん病巣は勿論のこと、検出できない微小ながん病巣も周囲の正常細胞を損傷せずに破壊できる、などというご説明を受けると、理論などは分からなくても、今までできなかった大きな障害を乗り越えることのできる、エポック・メイキングなことではないのだろうかと、非常に大きな期待を持ちます。
感覚的ですが、化学療法に分子標的薬というものが登場して大きな期待が寄せられたのに似ていて、正に放射線治療の分子標的版のような気がしますが。
が20ppm(μg/g)以上の濃度で選択的に集積すると、がんは約10倍量の放射線を受けがん細胞選択的照射が実現し、画像上のがん病巣は勿論のこと、検出できない微小ながん病巣も周囲の正常細胞を損傷せずに破壊できる、などというご説明を受けると、理論などは分からなくても、今までできなかった大きな障害を乗り越えることのできる、エポック・メイキングなことではないのだろうかと、非常に大きな期待を持ちます。
感覚的ですが、化学療法に分子標的薬というものが登場して大きな期待が寄せられたのに似ていて、正に放射線治療の分子標的版のような気がしますが。
略歴
小野公二(おの こうじ)
1974年、京都大学医学部卒業。川崎医科大学助手(放射線治療教室)を経て、京都大学医学部附属病院助手。その後、カリフォルニア大学サンフランシスコ校で博士研究員、エッセン大学医学放射線生物学研究所で客員研究員を経て、1988年、京都大学医学部講師(放射線医学講座)。1991年、京都大学教授(原子炉実験所附属原子炉医療基礎研究施設)。1992年、同施設長、2005年、同粒子線腫瘍学研究センター長(名称変更)。現在に至る。
日本放射線腫瘍学会元理事・元会長、現監事、日本医学放射線学会・元生物部会長、放射線治療専門医(JASTRO/JRS共同認定)、国際放射線研究連合理事(医学担当)、日本中性子捕捉療法学会初代会長、国際中性子捕捉療法学会評議員、日本学術会議連携会員(平成20年〜24年)
1974年、京都大学医学部卒業。川崎医科大学助手(放射線治療教室)を経て、京都大学医学部附属病院助手。その後、カリフォルニア大学サンフランシスコ校で博士研究員、エッセン大学医学放射線生物学研究所で客員研究員を経て、1988年、京都大学医学部講師(放射線医学講座)。1991年、京都大学教授(原子炉実験所附属原子炉医療基礎研究施設)。1992年、同施設長、2005年、同粒子線腫瘍学研究センター長(名称変更)。現在に至る。
日本放射線腫瘍学会元理事・元会長、現監事、日本医学放射線学会・元生物部会長、放射線治療専門医(JASTRO/JRS共同認定)、国際放射線研究連合理事(医学担当)、日本中性子捕捉療法学会初代会長、国際中性子捕捉療法学会評議員、日本学術会議連携会員(平成20年〜24年)
