『認知症を予防し、早期診断し、そして早期治療する。』
岸 和史
がんもまた高齢者に好発するので、認知症とがんを併発するケースがこれからの大きな問題となってくる。
この度、北海道大野記念病院副院長で放射線治療センターセンター長の岸 和史先生から認知症に関する興味深いご寄稿を頂いたので、掲載させていただきます。
はじめに
誰もなりたくない「認知症」。でも、いつか自分もなるかもしれない障害。60歳以上の約5.5%が陥る障害です。どうすれば防ぐことができるのか。今の医療の方法でどれだけ回避できるのか、少し順をおってお話ししましょう。
認知症の始まりとその影響
一度は正常に発達した知能が不可逆的に低下した状態を私達は認知症と呼んでいます。認知症では初めに「最近の事柄の記憶」の障害、「失見当識」といって今自分のいる場所が分からなくなる障害が現れます。これは神経細胞の脱落で発生する機能障害です。
そういった障害を背負うと、それがさらに解決の難しいストレスになり、ふさぎ込んだり、時に攻撃的になってしまったり、外から見れば一見「人格が変化したようになる」ことがあるでしょう。これらは先にのべた機能障害のために取った対応ということができるでしょう。もっと病気が進行してしまうと脳は委縮してしまいます。
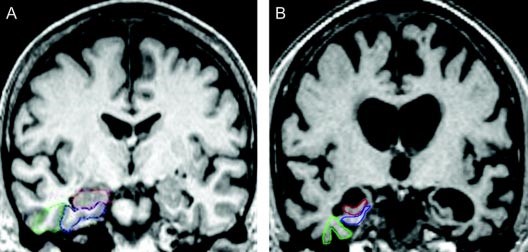
このMRI画像は、左は正常の脳のMRI、右は進行したADの患者さんの脳のMRIです。進行したADでは脳は委縮して全体に小さくなり、特に近時記憶の中枢である海馬(hippocampus)は小さく委縮しています。
北米放射線学会の提供によるradiologyinfo.orgの画像です。
http://www.radiologyinfo.org/en/info.cfm?pg=alzheimers
認知症の頻度や性差
【国よって差がある】先ほど述べた同じ60歳以上の認知症発症頻度にも国によって2倍の差があります(下図)。どうやら国が安定し、社会資本が充実し全国民の生活が安定している国ほど発症率が高い印象を受けます。
【年齢とともに増加。女性に多い】また、同じ60歳以上では、認知症発症頻度には年齢、性別で差があります。90歳以上では発症頻度は40%以上、そして70歳以上では女性の発症が多くなります。女性のほうが長生きするから、ではありません。
後で、述べます認知症予防で一番大きなウエイトを占める対策は「運動」ですが、75歳以上では性差が現れ始め、筋肉を維持したり増加させたりする能力において女性より優る男性にアドバンテージがあるようです。
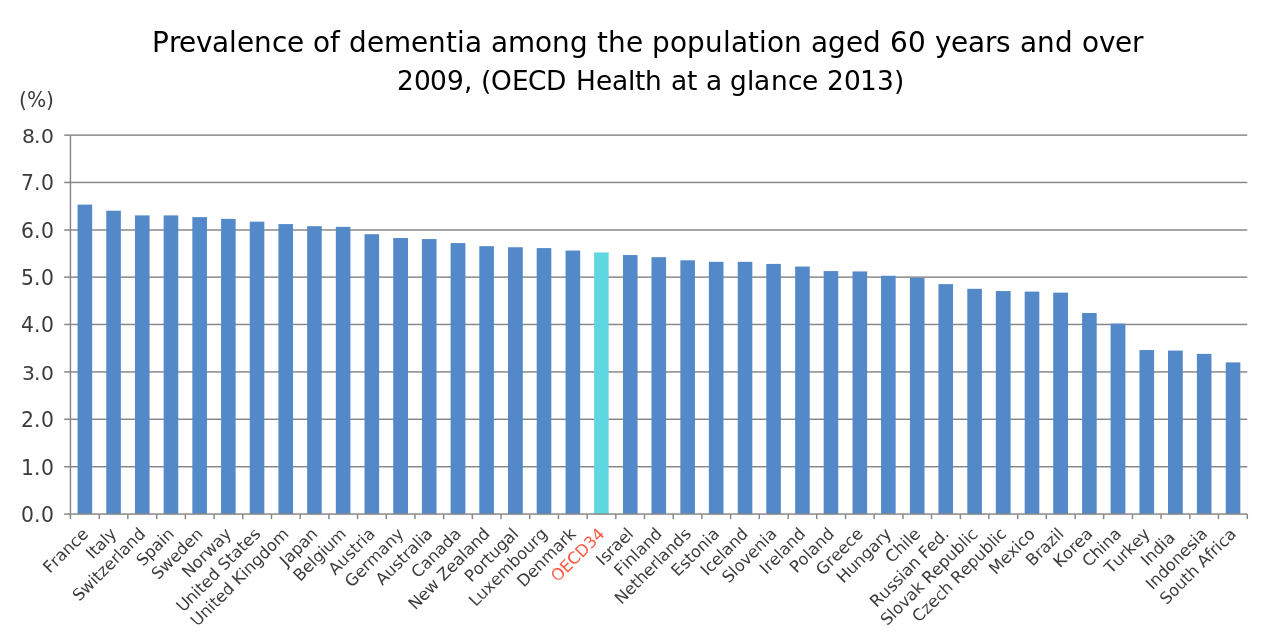
図1:同じOECD加盟国の中でも60歳以上の認知症発症頻度は国によって2倍の差がある。
出典 Prevalence of dementia among the population aged 60 years and over, 2009 You or your institution have access to this content OECD, DOI: 10.1787/health_glance-2013-graph173-en
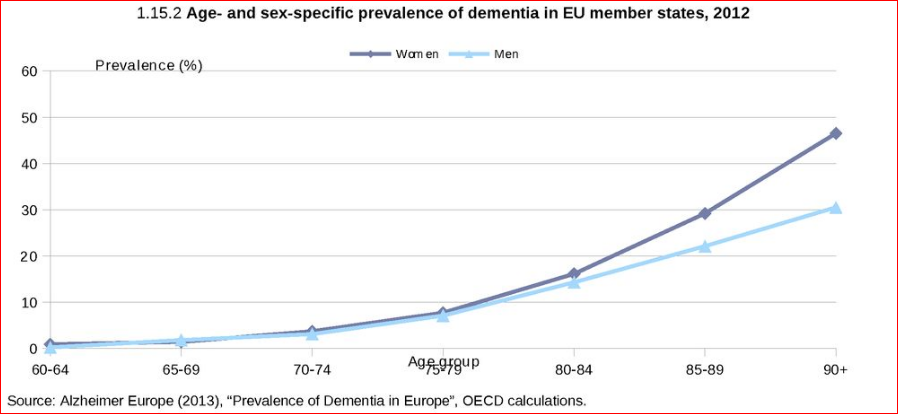
図、年齢、性別で差がある。90歳以上では発症頻度は40%以上、そして70歳以上では女性の発症が多くなる。
Prevalence of dementia, population aged 60 years and over, 2012
DOI:10.1787/health_glance_eur-2014-graph37-en
認知症の管理
1.もとになる病気の基本的な管理認知症の元になる病気には、①脳血管障害、②アルツハイマー病などの変性疾患、③正常圧水頭症、④ビタミンなどの代謝・栄養障害、⑤甲状腺機能低下などがあります。
このなかには普段から健康管理に注意して防げることもたくさんありますので認知症になりにくい「健康な脳」をまず、保つようにするべきですね。
2.認知症の予防認知症の多くは、アルツハイマー病(AD)などの変性疾患:神経細胞群が徐々に死んでゆく病気、として発生します。これらの知識はまだ新しく断片的なことが多く、学問的には緻密な全体像が描けているとは言えません。つまり、どのような予防が科学的に最良なのか、どのようなお薬や治療がそうなのか、まだ、研究者たちは試行錯誤の最中です。
このような時は、世間では不確かな情報があふれがちです。慎重に、自分で見極めていく姿勢が大切になります。私は少しガイドをしましょう。
アメリカはこの予防について国をあげて取り組んでいます。政府のサイトを見てみましょう。
https://www.nia.nih.gov/alzheimers/publication/preventing-alzheimers-disease/search-alzheimers-prevention-strategies
(この原稿では、本文と翻訳は省略しています)
じっくりとこの内容を吟味すると、運動や自発的な行動、社会的な活動を維持する事、そして陽性の情動を持ち続けることが、健全な脳を保つために大切だというメッセージを読み取ることができます。リハビリテーションを含む運動療法が世界で盛んになってきていることも頷けるでしょう。
【今存在する認知症の治療薬】これは対症治療薬しか存在しません。
アルツハイマー病などの認知症の始まりの症状、中核症状は、物忘れです。この物忘れに対する対症的治療薬ドネペジル(アリセプト)は日本で生まれました。このお薬は神経を通して情報を伝える際に活躍するアセチルコリンという物質を神経細胞の中で分解されずに長く留め、その結果として記憶力を維持させます。いまでは同様な作用のお薬が数種類世界で販売されています。これらは多くの方のADやLDの進行を遅らせることに貢献してきました。
認知症の症状がでてしまう根本原因は、神経細胞の脱落です。ドネペジルなどのお薬は、疲れて死にそうになった神経細胞のなかで、それでもアセチルコリン濃度を維持させることで、記憶を保持させる役割を果たし役には立ちますが、神経細胞を不死にしたり再生させたりするお薬ではありません。
疲れて死にそうになった神経細胞は、なぜそうなるのでしょうか?どうすればシナせずにすむのでしょうか?どうすれば再生するのでしょうか?
なぜ脳細胞は死滅するのか~原因の探求
神経細胞の生存の邪魔をして認知症を発症させる物質は、アミロイドβ、および、タウタンパク質であることが最近の研究で判明しました。
【アミロイドβの出処】分子医学的なお話しになりますがここではとても大切なことを述べます。体のあらゆる細胞にはいろいろな膜貫通蛋白があり、受容体や接着分子として細胞の外と中を機能的につないでいます。脳でも脳神経の成長や修復に欠かせません。この膜貫通蛋白は機能的な分子の群れからなり、酵素(セクレターゼ)で分解されていくつかの分子に分かれます。この中にアミロイドβという原繊維の状態のペプチドが含まれます。それで該当する膜貫通蛋白のことをアミロイド前駆体蛋白(APP)と呼ぶことがあります。原繊維の状態のアミロイドβは緩く伸びた形で体内で分解を受け代謝を受けます。しかし代謝されず、蓄積が続くと沈着します。不溶性の巨大なアミロイドβシート分子塊は何千ものそれが互いに積み重なり、隣り同士の相互作用で凝集し不溶性となったものです。
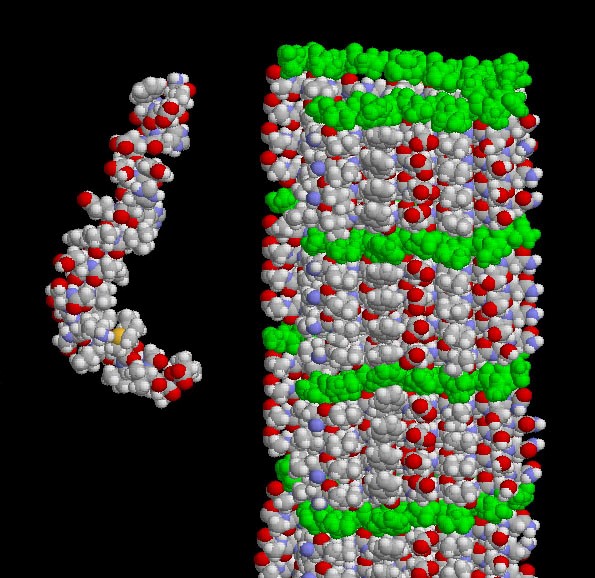
図:分子構造:アミロイド原線維(左)とβシート(右).
©Protein Data Bank Japan (PDBj) licensed under CC-BY-4.0 International
一度にたくさんのアミロイド前駆体蛋白が分解されるような状態、と、アミロイドβ原繊維が代謝されない状態は、アミロイドβを蓄積させます。酸素濃度5%の低酸素状態で組織のアミロイドβが過剰産生される事(Donq J, et al. Biochem Biophys Res Commun. 2011 Jun 24;410(1):40-4. doi: 10.1016/j.bbrc.2011.05.101. Epub 2011 May 24. Hypoxia induces beta-amyloid in association with death of RGC-5 cells in culture., Shiota S et al. Chronic intermittent hypoxia/reoxygenation facilitate amyloid-β generation in mice. J Alzheimers Dis. 2013;37(2):325-33. doi: 10.3233/JAD-130419.)は、酸素欠乏が蛋白の分解の引き金を引く事、アミロイドβ原繊維の代謝に酸素が必要な事*と関係しています。(*:Auerbach ID, Vinters HV. Effects of anoxia and hypoxia on amyloid precursor protein processing in cerebral microvascular smooth muscle cells. J Neuropathol Exp Neurol. 2006 Jun;65(6):610-20.) 一方ではアミロイドβは細胞内の酸素を使ってエネルギーを供給する装置であるミトコンドリアを破壊する事が知られています(田島一敝 他 日薬理誌(Folia Pharmacol Jpn) 134, 180-183, 2009)ので、酸素欠乏とアミロイドβの関係は悪循環に陥っていることが分かります。これが核心部分です。
周辺部分いくつかを見てみましょう。
大脳のアミロイド沈着は微小循環障害をもたらすことが分かっています。これを脳のアミロイド血管病変(Cerebral amyloid angiopathy)と呼びます。
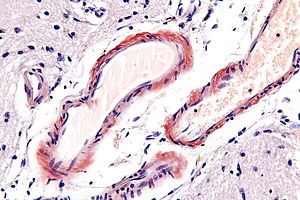
血管が大小3つ見えていますが、壁が赤くコンゴ赤で染まっています。この赤く染まっているところがアミロイド沈着です。このことは、アミロイド沈着は、血管の機能の何かを障害している病気であることを意味しています。少なくとも酸素の供給が障害を受けます。ここにも悪循環が見られます。 http://emedicine.medscape.com/article/1162720-overview
脳外傷でも脳のアミロイド血管病変が増加することが学術論文で報告されています。http://jnnp.bmj.com/content/76/2/229.full また、脳震盪や脳挫傷でもアミロイドβが増加することが多く知られています。https://pdbj.org/mom/79 これらは脳への外傷やストレスがアミロイド蛋白の蓄積を促進することを示唆します。脳神経細胞を痛めつけるのはアミロイドだけでなく、タウタンパク質というもう一つ毒性の高い物質があるようです。
【タウタンパク質】タウタンパク質は脳神経細胞の中に蓄積し神経細胞そのものを死滅させます。このタウ蛋白はもともと神経軸索内の分子量約5万の微小管結合蛋白で微小管の重合を促進したり安定化したりする働きをしているとても大切な、そして機能的にも重要な蛋白です。それが、異常が生じると細胞内で不溶性の凝集を作り軸索輸送がうまくいかなくなり神経細胞の死を招くことになります。まるで大切な人の気がふれていくときの悲劇のようです。脳のアミロイド血管病変がタウ蛋白の蓄積の原因になります。タウ蛋白質についてはこの付録3部分にも収めているのでお読みください。タウ蛋白はアミロイドに負けず劣らず低酸素に強く関係しています。Zhangらは急性の低酸素状態がタウ蛋白のリン酸化をもたらし記憶障害をもたらしたと報告しています(https://www.ncbi.nlm.nih.gov/pubmed/24993525)。
【アミロイドβとタウタンパク質と認知症の時系列】アミロイドβとタウタンパク質には織りなす時系列があることがよく知られています。
認知症予防協会のページでには次のように説明しています。
“初期段階ではアミロイドβの蓄積から始まりその約10年後からタウタンパク質の蓄積が始まります。それから更に約15年間アミロイドβとタウタンパク質は蓄積を続け、脳神経細胞を死滅させ認知症を発症させるということです。
発症は初期段階から約25年かかります。認知症は70歳頃からの発症率が高い為、その多くは〈70歳-25年間=45歳〉45歳頃からアミロイドβの蓄積が始まっている事になります。45歳を過ぎたら認知症予防を始めましょう。http://www.ninchi-k.com/?page_id=8“ この呼びかけには、画像でアミロイドβやタウ蛋白が見えるようになったという、医学の進歩にともなった根拠があります。
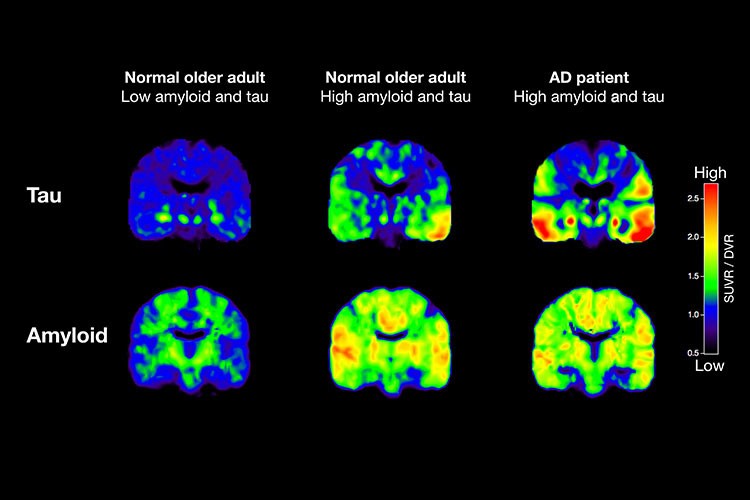
【アミロイドβの蓄積が始まっているかどうかわかる時代になった】認知症の原因蛋白の画像診断はここ10年で急速に進歩しました。下の図はPETスキャン画像です。左は正常の老人の脳。中央はアルツハイマー病は症候的には発症していない正常の老人の脳ですが部分的にアミロイドとタウ蛋白の沈着が高くなっています。右はアルツハイマー病を発症している患者さんの脳です。タウ蛋白の沈着がより一層強くなっています。そして海馬への集積が抜け落ちています。
このようにアミロイドの沈着はタウ蛋白よりも早く発生すます。タウだけが蓄積しているという所見がみられないために、アミロイド蛋白の蓄積がタウ蛋白の蓄積を助長していると考えられています。中央のような状態を、発症前の早期のアルツハイマーと呼びます。FDG-PETはがんの診断に使用されていますが、私が勤務している北海道大野記念病院で高精度のPET像診断装置を設置し、放射性診断薬の工夫によりこれらの脳内の病態の診断も行っています。
アミロイド蛋白をこのように画像化できるこの診断薬Florbetapir(Amyvid)は2012年に米国のFDAで承認されて世界中で使われるようになりました。日本ではアミヴィッド(フロルベタピル(18F)注射液)として2016年12月に製造販売承認が下りたばかりです。http://fri.fujifilm.co.jp/information/detail/161219.html
世の中の動きもこういった流れに敏感です。日本国内でもいくつかのPET健診センターが早くもこの検査の広告を始めました。しかしまだ治療方法や管理手段を伴った活動ができているところは残念ながら少ないのが現状です。北海道大野記念病院では認知症に関する診断だけでなく、その予防・治療に関するアドバイスや健康管理、医学的助言を行っています。
どうすればβアミロイド蛋白やタウ蛋白の蓄積を予防あるいは阻止できるか?
もし、あなたが、アミロイドβやタウ蛋白の蓄積が始まっていると診断されたらどうしますか?
日本政府やの権威のある大きな学会からの情報量はまだ少なく、組織の取り組みにしても日米の取り組みにはタイムラグがあります。
先ほど、大切な最近の興味深い最先端の研究報告を紹介しました。そこで、私が核心部分とよんだり、悪循環を指摘したりした部分は、強い脳の低酸素状態です。
それを回避するためには
- 1.日ごろから良好な血液循環状態の維持に努めること。
- 2.若々しい血管を保つ努力をすること。
- 3.筋肉を動かすこと。
- 4.極端なストレスを避ける事。
- 5.極端な疲労を避ける事。
- 6.脳の外傷的なダメージを避ける事。
- 7.組織の極端な低酸素状態を避ける事。
- 8.炎症・感染を回避する事。
アミロイド沈着は傷害や炎症の治癒過程で生じます。アミロイド沈着は脳では毛細血管を含む微小血管壁への沈着として発生することが知られています。この微小循環への影響は、組織の代謝に何等かの健全な影響を与えていると考えられます。直接的に言えば、毛細血管の壁を介する酸素や栄養素の透過に支障が出た結果、タウ蛋白に異常が発生し、蓄積するという可能性があります。上にあげた事項はアミロイドやタウ蛋白の蓄積を防ぐための当たり前の方法ということができるでしょう。
TIPS
【無酸素運動で認知症予防】有酸素運動と無酸素運動について説明します。有酸素運動とは常に十分な酸素が筋肉に供給されているような緩徐な運動の方法です。これに対して無酸素運動は筋肉の中でいったん乳酸が発生します。ほとんどのスポーツは多少なりとも無酸素運動を伴います。無酸素運動だからといって筋肉のアミロイド沈着は発生しません。無酸素運動は乳酸生成を促し、あるレベル以上の乳酸の生成はヒト成長ホルモン(HGH)やインスリン様成長ホルモン(IGF)を誘導することが知られています。成長ホルモンは主に脳の海馬(記憶に関係する部分)で脳由来神経栄養因子(BNDF)と言われてる神経系液性蛋白質の分泌を増加させます。この因子は脳神経細胞の生存と成長を促進し、認知症予防にはとても大切な物質です。脳の神経細胞を元気にし、認知症にならない丈夫な脳を作る為、運動を継続して行う事を心掛けてましょう。有酸素運動のみを推奨する必要はなく、無酸素運動のほうが有効にヒト成長ホルモン等の分泌を促進します。
【酸素ルームで極度の低酸素状態を回避し、血管新生を促進させる】大気中の酸素比率は20.5%で、大気圧は1気圧です。この時、コップの水は約150mmHgの溶存酸素分圧になります。もし酸素分圧が同じで1.3気圧に加圧した室内の中ではヘンリーの法則で溶存酸素分圧は30%アップし195mmHgになります。もし酸素比率が20%アップした1.3気圧の部屋の中では、溶存酸素分圧は1.2 x1.3 =156% アップします。ヒトの体のなかでは血管が赤血球を運搬して酸素を末梢の組織に届けるのですが、認知症になり始める年齢から、これらの能力が極めて低下し始めます。このレポートでは、認知症の発生において鍵となるアミロイドβの蓄積に極度の低酸素状態が重要な役割をはたしている事を述べましたが、加齢と共に低下した「血管が赤血球を運搬する能力」を酸素ルームが解決できる可能性があり、海外では臨床試験も行われています。https://clinicaltrials.gov/ct2/show/NCT02085330
まだ残念ながら認知症の予防の目的では保険の適用は認められていませんが、北海道大野記念病院でも医療用酸素カプセルおよび民生用酸素ルームの両方を備えています。
付録1
https://ninchisho-online.com/dementia/medicine/#i-2
=今使える認知症の対症治療薬=あくまで対症=アリセプト(ドネペジル塩酸塩)とは
アリセプト(一般名:ドネペジル塩酸塩 ※以下アリセプト)は、1999年10月の発売以来、日本における唯一の認知症治療薬として使われてきました。アルツハイマー病やレビー小体型認知症になると、記憶や思考に関わるアセチルコリンという神経伝達物質が不足します。アリセプトは、このアセチルコリンの分解を抑え、神経活動を高める働きをします。
アリセプトの概要・効果・副作用について詳しく知りたい方はこちらら
レミニール(ガランタミン)とは
レミニール(一般名:ガランタミン消化水素酸塩 ※以下レミニール)は、2011年3月に日本国内において2番目に発売されたアルツハイマー型認知症薬です。ジョンソン・エンド・ジョンソン・ファーマシューティカル・リサーチ・&・デベロップメントとシャイア社との間で共同開発されました。日本では新薬として注目されていますが、世界的に見るとすでに長年の実績のある薬剤です。2000年にスウェーデンで承認されて以来、10年以上にわたり80カ国以上の国と地域で使われています。
レミニールの概要・効果・副作用について詳しく知りたい方はこちら
イクセロンパッチ、リバスタッチパッチ(リバスチグミン)とは
認知症治療薬のなかで唯一の貼り薬として誕生した、イクセロンパッチ、リバスタッチパッチ。これは商品名で、リバスチグミンのパッチ剤です。アルツハイマー型認知症の症状の進行を抑制する薬であり、アリセプトやレミニールと同じアセチルコリンエステラーゼ阻害剤のひとつです。飲み薬としてのリバスチグミンは、1997年にスイスで開発されましたが、吐き気などの副作用が強すぎたため、普及しませんでした。その後、リバスチグミンが低分子であることを活用して、パッチ製剤として開発が進められました。
イクセロンパッチ、リバスタッチパッチの概要・効果・副作用について詳しく知りたい方はこちら
メマリー(メマンチン)とは
メマリー(一般名:メマンチン ※以下メマリー)は、認知症治療薬として唯一、他の中核薬と併用が可能なお薬です。中等度~高度にかけてのアルツハイマー型認知症の治療に多く用いられます。アリセプト、レミニール、イクセロンパッチ、リバスタッチパッチが「アセチルコリンエステラーゼの働きを阻害する」のに対し、メマリーはまったく違う作用機序を持ちます。日本での発売が始まったのは、2011年6月。メマリーの登場によって、認知症治療の選択肢が広がりました。
付録2
タウ蛋白の異常が何をもたらすかアルツハイマー病の脳では、異常にリン酸化された神経軸策内のタウタンパク質が樹状突起スパインへ転移し、神経変性が引き起こされる。
機能タウタンパク質は中枢神経系および末梢神経系の神経細胞やグリア細胞(アストロサイト、オリゴデンドロサイト)に発現している、元々は溶解度の高いタンパク質で、微小管結合タンパク質(MAP)の一種として発見され、微小管の重合や安定化を調節しています2,3。また微小管以外にもさまざまなタンパク質と結合しており、生後の脳の成熟、軸策輸送およびそのシグナル伝達の調節、熱ストレスに対する細胞応答、成体での神経発生など、神経系で起こるさまざまな現象に関わっています。このタウタンパク質の異常は、アルツハイマー病などの神経変性疾患の原因となると考えられています1,4。
構造タウタンパク質はその機能から、N末端近傍領域、プロリンリッチ領域(PRD)、微小管結合領域(MBD)、C末端近傍領域の4つの領域に分けられます5。ヒトのタウタンパク質遺伝子(MAPT)は16のエクソン領域を有し、エクソン2、3、10が選択的スプライシングされ、6種類のアイソフォームがあります(Figure 1)。
タウタンパク質のリン酸化は細胞骨格構造の維持に重要ですが6,7、そのリン酸化の異常がアルツハイマー病に関与しています。タウタンパク質のリン酸化部位はセリン(S)、スレオニン(T)、チロシン(Y)合わせて85箇所ありますが、そのうち約45箇所が異常リン酸化に関連していると考えられます6,8。
なおタウタンパク質はリン酸化以外にも、グリコシル化、トランケーション、ニトロ化、酸化、重合化、ユビキチン化、SUMO化、凝集などさまざまな翻訳後修飾を受けます9。
http://www.abcam.co.jp/neuroscience/tau-in-alzheimers-disease-1
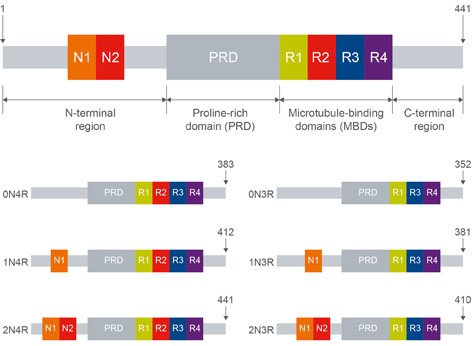
Figure 1. タウタンパク質は選択的スプライシングにより、352~441アミノ酸長となる6種類のアイソフォームが存在し、それぞれのアイソフォームはN末端近傍領域と微小管結合領域が異なります。N末端近傍領域にはN1とN2という2種類のインサートがあり、タウ遺伝子のエクソン2および3のそれぞれにコードされています。選択的スプライシングによりエクソン2および3の両方が欠損すると0N型、エクソン2のみがある場合は1N型、エクソン2および3の両方がある場合は2N型のアイソフォームとなります。微小管結合領域はR1~R4で表される4つの領域に分類され、そのうちエクソン10にコードされているR2の有無で4R型もしくは3R型のアイソフォームとなります。
アルツハイマー病における役割認知症の代表的な疾患であるアルツハイマー病患者の神経組織における特徴は、細胞外のアミロイド β(Aβ)によるプラーク形成(アミロイドβ斑・老人斑)と、細胞内の異常リン酸化されたタウタンパク質による神経原線維変化(NFTs)です10。アミロイドβ斑とNFTsはいずれも、不溶性で高密度に繊維化したタンパク質の凝集です。アルツハイマー病ではこれら蓄積したタンパク質が神経細胞にダメージを与え、細胞死を引き起こします11。その経路は次のようなものであると考えられています。
細胞内の可溶性Aβが増加するとタウタンパク質の異常リン酸化が誘導され、微小管から可溶性の単量体タウタンパク質が遊離します6,12。遊離したタウタンパク質は軸策から神経細胞の細胞体樹状突起部分に移動し12、Srcチロシンキナーゼであるfynと相互作用し、fynを樹状突起に局在させます13。高濃度となったfynは活性化して興奮性NMDA受容体GluN2Bをリン酸化し、安定化します。これによりグルタミン酸シグナル伝達が増幅され、細胞内へのCa2+流入量が増加し、Aβの毒性が増加します11,13,14。カルシウム誘導型の興奮毒性はシナプス後部にダメージを与え、ミトコンドリアのCa2+過負荷、膜の脱分極、酸化ストレス、アポトーシスなどを誘導します7,11,15,16。
アミロイドβ斑やNFTsはプリオンのように、異常なタンパク質から正常なタンパク質へと異常性が伝播しますが、これには細胞外小胞が関係しています17,18。
アルツハイマー病の治療はさまざまな方法が試みられていますが、その中でタウタンパク質に着目したものとして、樹状突起のfynやタウタンパク質の局在を減少させ、Aβやタウタンパク質の増加で誘導されるNMDA受容体活性化を防ぐ方法があります19,20。
付録3
脳のアミロイド血管病変がタウ蛋白の蓄積の原因であることを示唆する報告
https://alzres.biomedcentral.com/articles/10.1186/alzrt6
Roy O Weller 著
Amyloid is deposited in the walls of arteries and capillaries as cerebral amyloid angiopathy (CAA) in the brains of older individuals and of those with Alzheimer disease (AD). CAA in AD reflects an age-related failure of elimination of amyloid-beta (Aβ) from the brain along perivascular lymphatic drainage pathways. In the absence of conventional lymphatic vessel in the brain, interstitial fluid and solutes drain from the brain to cervical lymph nodes along narrow basement membranes in the walls of capillaries and arteries, a pathway that is largely separate from the cerebrospinal fluid. In this review we focus on the pathology and pathogenesis of CAA, its role in the aetiology of AD and its impact on immunotherapy for AD. The motive force for lymphatic drainage of the brain appears to be generated by arterial pulsations. Failure of elimination of Aβ along perivascular pathways coincides with a reduction in enzymic degradation of Aβ, reduced absorption of Aβ into the blood and age-related stiffening of artery walls that appears to reduce the motive force for lymphatic drainage. Reduced clearances of Aβ and CAA are associated with the accumulation of insoluble and soluble Aβs in the brain in AD and the probable loss of homeostasis of the neuronal environment due to retention of soluble metabolites within the brain. Tau metabolism may also be affected. Immunotherapy has been successful in removing insoluble plaques of Aβ from the brain in AD but with little effect on cognitive decline. One major problem is the increase in CAA in immunised patients that probably prevents the complete removal of Aβ from the brain. Increased knowledge of the physiology and structural and genetic aspects of the lymphatic drainage of Aβ from the brain will stimulate the development of therapeutic strategies for the prevention and treatment of AD.
アミロイドは、高齢者およびアルツハイマー病(AD)の脳における脳アミロイド血管障害(CAA)として、動脈および毛細血管の壁に沈着する。ADにおけるCAAは、血管周囲リンパ管路に沿った脳からのアミロイド - ベータ(Aβ)の排除の加齢に関連する障害を反映している。脳内の従来のリンパ管がない場合、間質液および溶質は、毛細血管および動脈の壁の狭い基底膜に沿って脳から脳脊髄液リンパ節へと流出し、この経路は脳脊髄液から大きく離れている。このレビューでは、CAAの病理および病因、ADの病因におけるその役割およびADに対する免疫療法へのその影響に焦点を当てる。脳のリンパ排液の動因は、動脈の脈動によって生じるようである。血管周囲経路に沿ったAβの排除の失敗は、Aβの酵素分解の減少、血液中へのAβの吸収の減少、およびリンパ排液の動因を減少させると思われる動脈壁の硬化関連の硬化と一致する。AβおよびCAAのクリアランスの低下は、ADにおける脳内の不溶性および可溶性Aβの蓄積および脳内の可溶性代謝産物の保持による神経環境のホメオスタシスの喪失に関連する。タウ代謝も影響を受け得る。免疫療法はADの脳からAβの不溶性プラークを除去することに成功したが、認知低下にほとんど影響を与えなかった。1つの大きな問題は、おそらく脳からのAβの完全な除去を予防する、免疫化された患者におけるCAAの増加である。脳からのAβのリンパ排液の生理学および構造的および遺伝的側面の知識の増加は、ADの予防および治療のための治療戦略の開発を刺激する。(グーグル自動翻訳)
1983年和歌山県立医科大学医学部医学科卒業後、同大学助手(放射線医学講座)、講師、助教授、准教授を経て2013年医療法人北斗 北斗病院放射線治療科部長、2014年より副院長。2016年10月15日の開院日をもって現職。
この間1997年米国テキサス州立大学MDアンダーソン癌センター実験放射線腫瘍学教室にPostdoctoral Fellowとして留学
日本放射線腫瘍学会認定医、放射線治療専門医、医学博士