『がんの光免疫療法の基礎』
小林 久隆
半世紀以上前から現在に至るまで、臨床におけるがんの三大治療方法は、変わらず外科手術、放射線治療、化学療法(抗がん剤)である。 がんは言うまでもなく体の中にがん細胞と言う余分な細胞が増殖することによって起こる病気であるので、これらの細胞を取り去るあるいは体の中にあるこれらの細胞を減らしていくことががん治療の目的となる。 その意味では三大治療はすべて直接がん細胞を攻撃しまたは取り去って体の中にあるがん細胞を無くす、または減らしていくことを目的にしているので合理的な方法である。 ただどの治療法も体の中のがん細胞だけを取り除くまたは攻撃して殺してしまう事は今のところまだできていない。 従って正常な細胞も取り去られたりダメージを受けたりするのでそれががんの治療の副作用の原因となり患者を苦しめている。
前記の三大治療はいずれも、正常細胞、その中でも特に免疫担当細胞を強く傷害することによって、生体のがんに対する免疫を落としてしまう。 例えば、外科治療は定型的には腫瘍と共に所属リンパ節を切除する。 これは、がんと戦っている腫瘍内浸潤リンパ球に加えて、免疫を開始して進める役割も担う局所のリンパ組織も失われてしまう。 放射線治療は通常、がんに対しては60-80Gy(2Gy/日x30-40回)の放射線の照射を必要とするが、がんと闘うのに最も重要なTリンパ球は放射線感受性が高く2-3Gyの照射で死んでしまう。 従って、最初の2日間の照射で腫瘍内及び局所リンパ節を含む周辺のリンパ球はすべて死に絶えてしまい、治療終了後にリンパ球が回復するまでは腫瘍免疫はほぼ期待できないことになる。 一般の化学療法剤も同様で、多くの場合分裂が盛んな細胞が障害されることが多いため、血球系の細胞は障害されることが多く、白血球やリンパ球の減少は頻繁に観られる副作用である。
近年がんに対する免疫の機構が科学的に解明されることにより、体の免疫力を増強することによってがんを治す様々ながん免疫療法が確立してきた。 現在行われているがん免疫療法は、免疫賦活効果を持つ薬剤を用いるサイトカイン療法や免疫チェックポイント阻害剤、がんの特異抗原を同定して狙うワクチン療法やCAR-T療法などすべて、 がん患者の中にある既存の免疫細胞を活性化するか、一つのがんに特異的と思われる抗原を狙った免疫細胞を加えることによって、その免疫細胞ががん細胞を殺しきることで、がんを治癒させるわけである。 従って、これらの免疫療法自体によっては一つもがん細胞が殺されることはないわけで、がんを完治させるためには活性化された免疫細胞は生体内にあるすべてのがん細胞と戦い殺しきる必要がある。 がん細胞を殺しきるためには、大変多数の活性の高い免疫細胞が必要になり、元来患者さんの体の中にある、あるいは培養して投与された免疫細胞の数と質が十分でなければ、免疫療法は十分な効果が得られない。
このように理論的には、がん細胞の生体内の数を減らしながら、がんに対する免疫を増強あるいは少なくとも現状維持できる治療がより効果があるはずである。 だが、こうして現在のがんの臨床の現状を見ると、そのような治療は既存の治療の組み合わせのみでは実現することが難しい。 この状況を合理的に実現するためには、まず免疫細胞を含めた正常細胞を傷つけることなくできるだけがん細胞のみを殺す。 そしてさらに、殺したがん細胞を物理的に壊すことによって、がん細胞に存在する抗原をそのままの形で大量に免疫細胞に認識させてより良い免疫を誘導する必要があるわけである。 私たちは近年、この理想を実現するために、化学・物理・生物学を統合した集学的理論に基づいて、新しい治療の方法論を合理的に組み上げ、さらに実際にがんの臨床に応用する事ができる治療法の開発を目指して研究を進めてきた。 そして、2011年に近赤外線を用いた近赤外光線免疫療法(Near Infrared Photoimmunotherapy; NIR-PIT)を完成した。 この項では、近赤外光線免疫療法の免疫誘導理論を中心に解説したい。
近赤外光線免疫療法の基本理論
投与された薬剤は、どのような薬剤もまず、必ず細胞の外に存在することになる。 細胞膜は細胞の最も強力な外敵からの防御機構であり、当然、薬剤にとっても最も超えることの難しい障壁である。 細胞にとっては、細胞膜が壊れればいかなる細胞も生きてはいけないわけである。 生物学的には、細胞膜を壊す方法は決して多くはない。 しかし、物性的な観点からすれば、イオン強度の違いを持つ2つの液体を隔てる水中にある脂質の二重膜であるので、物理、化学的にその機能を障害して破壊することはそれほど難しいことではない。 ただ、すべての細胞を傷害するわけにはいかないので、選択性を持つ分子で高い選択性を取ることが生物学的・薬学的には必要になる。
数ある既存の生体内分子の中で、生きた細胞の膜表面分子に最も特異的に安定して結合する事ができる種類の分子は、抗体をおいてほかにはない。 実際に、病理学での癌の診断も、現在でも多くは抗体の特異性を用いた免疫組織染色によるところがほとんどである。 最も利用しやすいIgGクラスの抗体を用いた治療は、数多く開発され年々その数は増加している。 抗体は、いくつかのサブクラス(IgG1, IgG4)の抗体分子自体が、Antigen-dependent cellular cytotoxicity (ADCC)やComplement-dependent cytotoxicity (CDC)などの免疫機能を利用した殺細胞効果を持つ。 抗体単独治療は一定の効果を上げてはいるが、このような宿主の免疫系を介した抗体自体による治療効果のみでは効果が限定的であり、癌を完治させる事は難しいのが現状である。
さらにがんに対する効果を増強するため、抗体の癌細胞への結合特異性を生かして、殺細胞効果の強い薬剤(細胞毒素、免疫賦活剤、抗がん剤、放射性同位元素[β線、α線放出核種])を腫瘍細胞に運ばせて治療を行う方法、 いわゆる抗体薬剤結合体(Antibody-drug conjugate: ADC)も多く開発されている。 そのいくつかは既に、臨床応用がなされているが、殺細胞性薬剤が生理的代謝や排泄を行う臓器に毒性を起こすことがある上、 抗体の血中半減期が比較的長いため抗体に結合した放射性同位元素が発する放射能が放射線感受性の高い骨髄抑制を引き起こしてしまうなど、どこかの正常臓器の副作用がこのような抗体結合薬剤の投与量の限界となる。 このような致命的な副作用を避ける必要があるために、既存の抗体結合薬剤はがん治療に十分に必要な投与量を患者に投与することが難しく、決定的な癌の特異的治療となり得ていない。 結局、細胞自体を傷害する物質を生体に投与すると、必ずどこか(特に肝臓や腎臓などの代謝排泄経路)で正常の細胞にも障害が起こり、それが薬品の投与量を決めてしまうため十分な効果な期待できないことになる。 従って、抗体の「優れた抗原に対する結合」を癌治療に生かすためには、抗体が抗原に対して結合した細胞に対してのみ殺細胞効果を引き起こす新しい方法が必要である。 つまり、論理的にがんを治しきれる治療を作るには、「生体には一切害を与えない物質を用いてがん細胞のところでだけ毒にできる」仕組みを考える必要があるわけである。 この仕組みは、分子イメージング技術で特異的な描出をするために標的対バックグラウンド比を高める際に考案した、標的と結合した時のみにスイッチがはいる「アクテイベータブル」という化学に基づいた理論が応用できる。
薬物動態的観点では、抗体は比較的大きな分子であるので、生体内で生きた細胞の細胞膜を透過して細胞内に入り込むことは難しい。 従って、標的は細胞膜上になければならず、そこから細胞に障害を与える必要がある。 抗体が細胞膜上の分子に結合した時点で、抗体分子は細胞膜の非常に近く(数ナノメートル以内)にいる。 物理、化学的な効果で、細胞にダメージを与えるためには、標的細胞の場所においてのみ局所で物理的、あるいは化学反応を起こすエネルギーを効率よく発生する必要がある。 既知の現象の中では、光化学反応がこのような効果を起こしうるものの一つである。
ところが、生物で光を使うためには、いくつかの限界がある。 光化学反応を効率よく起こすためには、エネルギーの高い光子(波長の短い電磁波)を用いる必要がある。 しかし、X線やγ線を含む紫外線よりも短い波長の光を浴びると、すべての細胞はDNAに損傷を起こしてダメージを受けてしまう。 つまり、体外から光を照射した場合、光子が通過していく皮膚や正常の組織にダメージを与えてしまう。 従って、癌細胞のところのみで細胞毒性を起こすには、可視光かそれより長い波長の光を使う必要がある。 さらに、生体内にはコラーゲン、ヘモグロビン、水、といった光の吸収物質が多々あるため、体の深部に治療に十分な光子を到達させるためには、波長が700ナノメートルから850ナノメートル程度の近赤外領域の光子を使用する必要がある。
そこで私たちは、抗体に結合させる事によって癌細胞上に運ぶ事ができる分子で、 そこで効率よく700ナノメートルから850ナノメートルあたりの近赤外領域の光子を吸収して、何らかのエネルギーを発生し、抗体の付着した細胞のみを殺傷する事ができる化学物質の選択を試みた。 そしてその中から、最も効率よく細胞障害を起こせる抗体結合化合物を選んだ。 それが、IRDye700DX (IR700)といわれる珪素フタロシアニンの誘導体である。 抗体-IR700結合体は、以下に述べるように予測通り細胞の実験でも生体内腫瘍の治療実験でも、特異的かつ効率的な細胞障害効果を出す事ができた。 このような理論的な背景と至適物質の選択に基づいて、私は近赤外線を用いたNIR-PIT(近赤外光線免疫療法)を開発できたわけである。
近赤外光線免疫療法の細胞殺傷機序と効果
近赤外光線免疫療法の効果は、既存の他のがん治療と比べるとかなり異なるものである。 近赤外光を照射している間に、IR700に起こる光化学反応によって抗体-IR700結合体の付着している膜抗原タンパクを介して脂質二重膜に非常に急速に機能障害が進んで、 細胞形態が変化し主として細胞質の内容物が漏出して数分以内に壊死性細胞死(別名:免疫原性細胞死)がおこる。 従って、抗体-IR700結合体の結合した細胞のみを殺傷することができるわけである。 実際に、抗原を発現させた細胞と抗原を発現させない細胞との共培養系を用いて、抗原を発現している細胞が完全に死に絶える条件で近赤外光線免疫療法を行っても、隣接する抗原を発現していない細胞は全く障害を受けない。
生体内に腫瘍を移植したマウスの実験においても、抗体IR700結合体の集積した腫瘍に近赤外光を十分に照射した場合、 腫瘍細胞は照射終了直後には既にATP産生や糖代謝といった生存反応を失い、2-3日後には組織学的にも腫瘍細胞がほぼ完全に消失する。 腫瘍の大きさも近赤外光照射直後にはほとんど変化がないが、時間経過とともに縮小し2日程度で収縮し消失する。 抗体を分割投与して近赤外光を反復照射する治療計画を用いることによって、80%以上のマウスの腫瘍を完治させる事もできた。 腫瘍には、治療直後より急速に肉芽組織が形成される。 これは、近赤外光線免疫療法によって破壊された細胞からのATPやHMGB1の放出によるToll-like receptorなどを介した樹状細胞の成熟化や白血球の活性化と遊走、集積を反映していると考えられた。 現在、免疫が正常のマウスでの検討では、近赤外光線免疫療法で腫瘍の治療を行ったマウスでは、複数のがん細胞特異抗原に対するT細胞の免疫応答が捉えられてきており、 動物実験においても臨床の患者のがんに対しても近赤外光線免疫療法単独でも免疫応答が期待できる結果が得られつつある。
近赤外光線免疫療法の腫瘍免疫増強メカニズム:樹状細胞の活性化と多クローン性腫瘍抗原認識
近赤外光線免疫療法は、腫瘍細胞を壊して減らすことに加えて合理的に腫瘍細胞に対する免疫を活性化させることができる。 そこには次のような理由がある。前章で示したように、近赤外光線免疫療法は狙った細胞の細胞膜の機能を障害して細胞を破裂させることにより、選択的に壊死性(免疫原性)細胞死を引き起こす。 この細胞死が「免疫原性」と言われる所以は、このような形で選択的にがん細胞のみを壊した場合には、細胞構成物(タンパク、核酸など)が、 障害されない形で放出されて近傍の樹状細胞を活性化するとともに、大量で良質の腫瘍抗原としてリンパ球に提示される。 かつても、同じような発想でがん細胞をすり潰して患者に投与して免疫を誘導しようとした治療があったが、成功しなかった。 これは、タンパク化学からすれば当然で、このように細胞をすり潰してしまうと処理中に多くのタンパクを変性させてしまい抗原認識部位の壊れたタンパク質が多量にできるため、効率的にリンパ球を教育することができなかった。 近赤外光線免疫療法では、がん細胞から放出されるATP、Calreticulin、HMGB1といった細胞死のシグナルが樹状細胞の成熟を促進するうえ、 短時間で大量に放出される新鮮で条件の良い抗原分子を用いてリンパ球の教育を行うことができるため、新たな教育された多様ながん特異抗原を認識できるリンパ球を誘導することができる。 そのため、近赤外光線免疫療法単独でも、がん細胞を減らすのみならず、腫瘍免疫も増強することができるわけである。(図1)
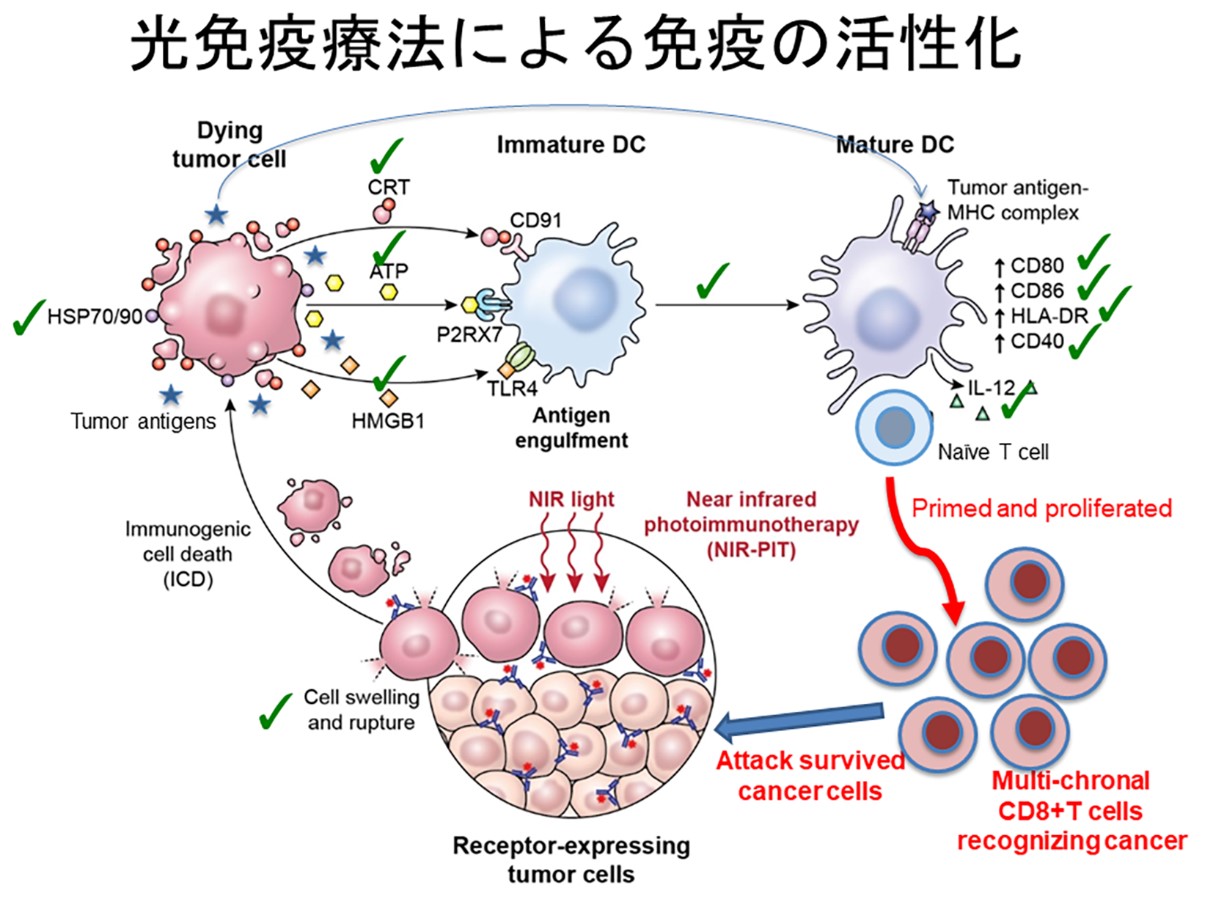
近赤外光線免疫療法の腫瘍免疫増強メカニズム:獲得免疫の活性化
近赤外光線免疫療法の手法を利用して、さらに強力に抗腫瘍獲得免疫を増強することができる。 それは、がん細胞を標的にする場合と同様の方法を用いて免疫抑制細胞を標的にした近赤外光線免疫療法で、免疫抑制細胞を短時間にほとんど取り除いてしまうことにより、がん免疫を活性化する免疫増強療法にも応用できることを証明した。 抑制性T細胞や骨髄由来抑制細胞は、樹状細胞から細胞殺傷性リンパ球まで多くの機序での免疫抑制を行っているので、全身で取り除くと自己免疫疾患を含む多様な副作用を起こしてしまう危険があるが、 近赤外光線免疫療法の手法によって腫瘍内と周辺にいる局所のこれらの細胞を取り除くことで、腫瘍特異的な免疫を局所のみならず全身で誘導して、 局所の残存細胞に加えて遠隔転移腫瘍に対しても抗腫瘍効果を大きな副作用なく出すことができる。 この当初からこの治療の名にあった「免疫療法」の部分に関しても、ADCCを起こさずIL-2の結合を妨げない免疫学的に最良と思われる新たな抗体を作成することにより、NIH内での臨床治験の準備を進めており現実のものになりつつある。
このがん細胞を標的にして壊して減らすとともにリンパ球を教育する近赤外光線免疫療法と、 免疫抑制細胞を標的にして抗腫瘍獲得免疫を増強する近赤外光線免疫療法は、理論的には高い相乗効果をあげられるはずである。 現在の近赤外光線免疫療法と全く同様の手技で、腫瘍細胞標的と免疫抑制細胞標的の2つの抗体IR700結合体をカクテルで同時に投与してから、近赤外光を照射することよって、より高い完治率を得られることが動物実験では証明できている。 さらにI型サイトカインや免疫チェックポイント阻害剤など他の免疫増強法とも併用して最適な腫瘍免疫を活性化できる近赤外光線免疫療法の方法論を決定するために多様な腫瘍モデルを用いて様々なコンビネーションでの前臨床試験を進めている。 現在認可されているがんを標的にした近赤外光線免疫療法はがんを必ず小さくすることはできるが、免疫を強く誘導する率がまだ低いため完治する率が低いが、 免疫抑制細胞との同時標的をはじめとした免疫増強法との併用によって完治率を飛躍的に高めていくことが予想される。 我々はそれがこの近赤外光線免疫療法の完成形であろうと考えている。(図2)
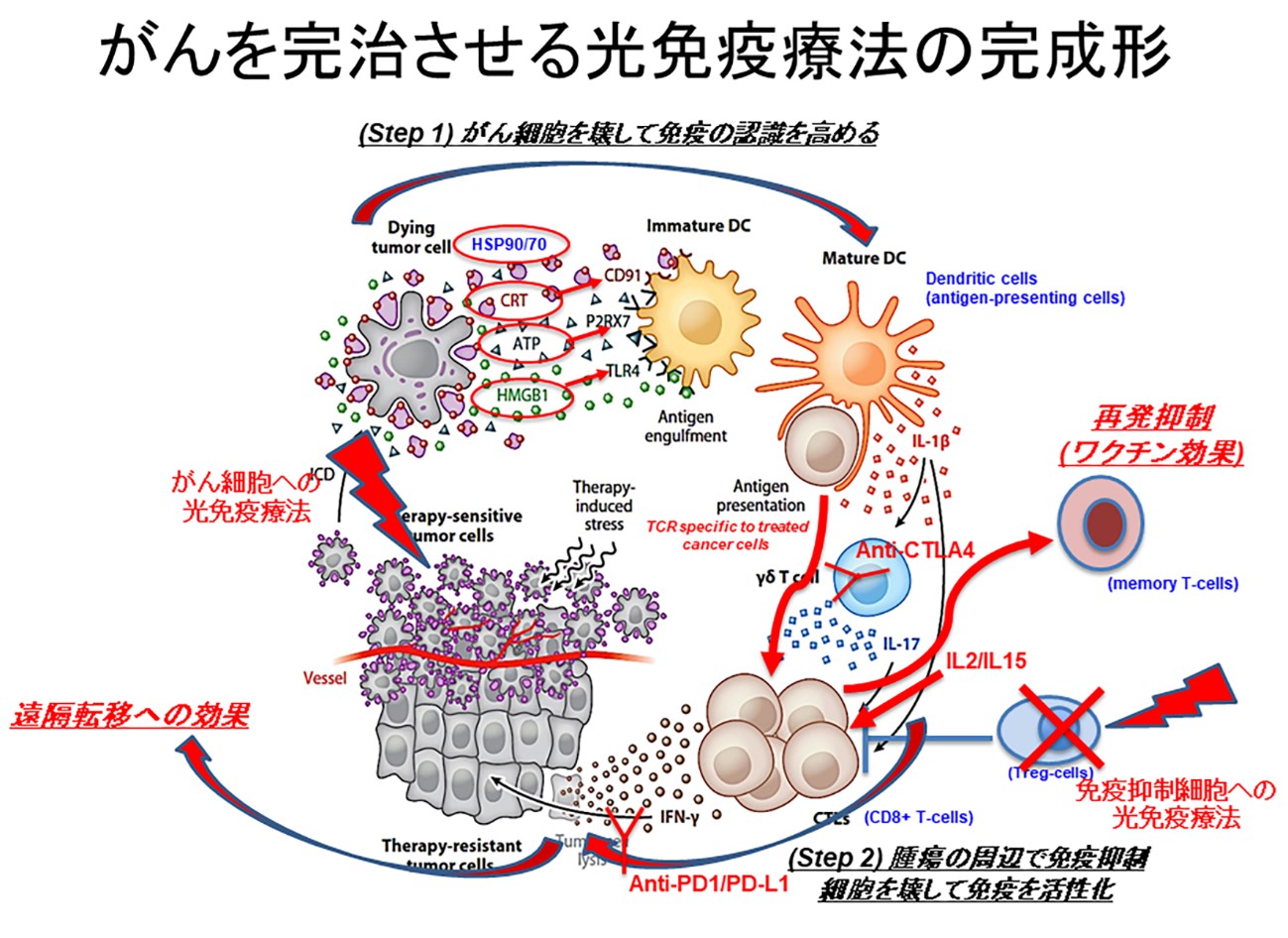
この記事では近赤外光線免疫療法の基本理論を説明し、この治療によってがん免疫の誘導、増強を起こせる理由を解説した。 専門家にも読んでいただけるように科学的に正確を期して書いたこともあり、やや難しい内容になっているかもしれない。 少し難しすぎると感じられる方は、一般向けにこの治療に関して書いて頂いた新潮社新書の芹澤健介さんの著書「がんの消滅:天才医師が挑む光免疫療法」か、 光文社新書の自著「がんを瞬時に破壊する光免疫療法 身体にやさしい新治療が医療を変える」などを参考にしていただければ幸いである。
定価:本体760円+税

◆がんの消滅 天才医師が挑む光免疫療法
定価:本体840円+税

1961年、兵庫県西宮市生まれ。 現在、NIH/NCI(アメリカ国立衛生研究所・国立がん研究所)分子イメージングブランチ主任研究員として勤務。 87年、京都大学医学部を卒業し、95年に京都大学大学院内科系核医学を専攻し修了、医学博士号取得。 同年に渡米、NIH臨床研究センターフェローに。98年に帰国し、京都大学医学部助手を経て、2001年に再渡米、NIHのNCIにシニアフェローとして勤務、05年から現職に。 11年、光免疫療法の論文が米医学誌『Nature Medicine』に掲載される。 光免疫療法の研究・開発により14年にNIH長官賞、17年にNCI長官個人表彰を受賞。他に7回のNIH Tech Transfer Award等を受賞。 22年4月より関西医科大学光免疫医学研究所所長(無給)を兼任。

